撰文︱王露曦
责编︱王思珍
小脑参与许多复杂的大脑功能,包括运动控制、语言和记忆[1]。在发育过程中,不同的神经细胞以时空限制的方式在小脑生发区产生。顺式调控元件(cis-regulatory elements,CREs),例如增强子和启动子,以及与它们结合的转录因子,是细胞命运规范和分化的核心。尽管大多数CREs在进化过程中经历了快速更新,但在一些脊椎动物中是保守的[2]。对CRE活性的批量测量促进了我们对小脑中基因调控以及器官发育过程中CREs进化动力学的认知。然而,目前在该领域CREs活性的大量测量中,往往缺乏评估细胞类型在调节约束中的差异,也缺乏区别细胞类型的特异性和分化相关的调节程序所需的细胞分辨率。之前的研究对整个器官的观察主要是通过减少细胞类型内的保守性而不是细胞类型的相对丰度的变化来解释的,这些变化具有明显的进化限制差异。
2021年8月,德国海德堡大学的Henrik Kaessmann课题组与德国癌症协会和德国癌症研究中心的Stefan M. Pfister课题组合作在Science发表了题以“Developmental and evolutionary dynamics of cis-regulatory elements in mouse cerebellar cells ”为题的最新研究,通过获取跨越11个阶段的约90000个细胞的snATAC-seq图谱,描绘了小脑细胞中基因调控的发育和进化动态,并提供了对哺乳动物器官发育的见解。

小鼠小脑发育阶段的snATAC-seq图谱
作者从早期神经发生(胎龄第10天)到成年(产后第63天)( 图1 A),共获得了11 个时间阶段的雄性和雌性小鼠小脑的snATAC-seq(single-nucleus assay for transposase accessible chromatin using sequencing,即转座酶可及染色质的单核测序)数据,使用迭代聚类分析和近似基因表达分析分确定了12种广泛的细胞类型和42种亚型和细胞状态,并绘制了单细胞染色质可及性图谱(图 1 B-E)。此外,作者对测序数据分析也发现,这些数据与常染色体CREs可及性的相关性最高。

图1 小鼠小脑发育的snATAC-seq图谱
(图源:Sarropoulos I, et al., Science, 2021)
小脑细胞类型的顺式调控景观
为了表征小脑细胞类型的调节特征,研究人员使用了簇特异性和复制感知峰值调用方法,确定了26多万个高可信度的CREs,这些CREs主要为内含子(51%)和基因间(26%)(图2 A)。这些CREs覆盖了约80%的在后脑发育过程中活跃的增强子,包括胎龄11.5天的小鼠后脑CREs(97%)和在发育中的小脑转录的增强子RNAs(82%)。作者也进行了迭代聚类分析,以描述小脑发育过程中CRE活动的模式(图2 B)。大多数(67%)的这些CREs与启动子相对应,而在其余的内含子和基因间CREs中,超过50%的CREs包含一个CTCF基元,表明其在结构方面的作用;而且,作者也观察到,在多种早期出生的神经元类型、胶质细胞类型和晚期出生的细胞类型存在活跃的CREs组,相当大比例的CREs具有多功能活性(图2 B)。 总之,这些分析(图2)提供了小脑发育过程中CREs活性的综合特征,并强调了基因调控的细胞和时间特异性。

图2. 小脑发育中CREs的活性:261,642 个假定 CRE 的基因组特征(A);跨细胞类型和发育阶段的 CRE 活动集群(B)
(图源:Sarropoulos I, et al., Science, 2021)
祖细胞异质性反映细胞命运决定
小脑发育依赖于细胞类型规范的空间和时间限制模式[2]。作者们提出疑问:GABA能深核神经元、浦肯野细胞、中间神经元和星形胶质细胞来源于心室区的祖细胞,那么这种细胞命运规范模式是否与小脑祖细胞之间的异质性有关?为此,研究人员对来自星形胶质细胞谱系的细胞进行亚群分类,并鉴定了整个小脑发育过程中所有生发区域的祖细胞(图 3 A-D),表明了一个额外的、分子上不同的早期祖先的前细胞群体的存在。尽管在整个小脑发育过程中,祖细胞之间的时空异质性显著,但早期阶段CREs活性的时间差异更强,这些CREs活性差异往往在细胞生发区之间共享,并导致相应的基因表达变化(图3 E-H)。

图3 小脑祖细胞群体的时空异质性
(图源:Sarropoulos I, et al., Science, 2021)
神经元分化过程中的调节活动
接下来,作者重点描述了三种最丰富的神经元类型,即颗粒细胞、浦肯野细胞和中间神经元,分化背后的基因调控程序。将来自不同发育阶段的细胞沿着它们的分化轨迹对齐,并使用扩散伪时间建模。作者观察到,从CREs近端到与胚胎发育和细胞命运相关的基因逐渐过渡到在神经元分化、迁移和轴突引导中起作用的基因,并最终形成突触、神经递质分泌和离子传输。为支持这种生物过程的融合,43%具有跨假时间动态活动的蛋白质编码基因由至少两种神经元类型共享。相比之下,只有20%的动态CRE在神经元类型之间共享,与基因表达相比,进一步突出了基因调控的细胞类型特异性(图4 A-B)。进而确定了在分化过程中具有动态活性的转录因子,包括激活性转录因子和抑制性转录因子。这些转录因子包括已知的调节因子,如颗粒细胞中的BARHL1和ETV1,浦肯野细胞中的OLIG2和FOXP2(图4 C)。作者也观察到分化状态和发育阶段都导致发育过程中基因间CREs保守性的降低,处于早期分化状态和发育阶段的细胞显示出最保守的调节程序(图4 D)。多效性CREs在不同神经元类型中表现出相似的活动曲线,除中间神经元外,多效性CREs在神经元分化的早期更常见(图4 D-H)。另外,对比已发表的scRNA-seq 数据[3,4],作者观察到与时间动态CREs相邻的基因的相似发育模式,表明CREs可及性的这些差异影响基因表达。

图 4 神经元分化中的基因调控。
(图源:Sarropoulos I, et al., Science, 2021)
CREs在小脑发育中的进化动力学和不同细胞类型的CRE约束差异
前述结果表明受发育过程中 的CRE活性的时间动态(图 2)、细胞类型特化(图 3)和分化(图4)的驱动,研究人员进一步提出疑问:这种差异是否也反映在CRE的进化历史中呢?
作者通过使用进化保守性的估计(phastCons分数)[5]评估了对CRE序列的功能选择性约束,并使用小鼠和其他16种脊椎动物之间的同线序列比对推断最小年龄。在所有细胞类型中,序列约束和基因间CREs的预测年龄在发育过程中显著降低(图5 A)。当细胞类型开始分化时,在哺乳动物之间甚至在哺乳动物之外共享的古老CREs在胚胎发育过程中表现出更高的活性(图 5 B)。随着细胞类型成熟并激活其末端效应基因,真兽类和鼠科啮齿动物特有的元素逐渐增加它们的活性,可能有助于祖先细胞类型的物种或谱系特异性表型创新。相一致地,转录因子基因是细胞类型识别的核心,而且与年龄更大、约束更强的CREs相关(图5 C)。作者也发现,颗粒细胞的分化状态(拟时间)和发育阶段会导致发育期间的基因间的CRE保守性降低,细胞的早期分化和发育阶段具有最保守的调控程度。作者也发现,颗粒细胞祖细胞,在不同的发育阶段形成单个细胞群(cluster),尽管这些细胞总体上高度相似,但是具有显著时间活动变化的CREs。
在分化过程中,CRE多效性(图4 F-H)和序列守恒性(图5 A)均下降,同时鉴于多向性对调控序列的进化施加了限制,那么作者提出疑问:这是否可以解释CRE保守性的减少。结果表明,在多效性状态下,多效性CREs明显比动态CREs更保守(图5 E)。因此,随着CRE多向性在发育和分化过程中减少,对CRE序列的约束放松,这与前面对基因表达的观察结果一致。研究人员还观察到,所有器官中10种最保守的细胞类型中有8种是神经细胞(图5 F),强调了大脑中整体更强的进化限制。
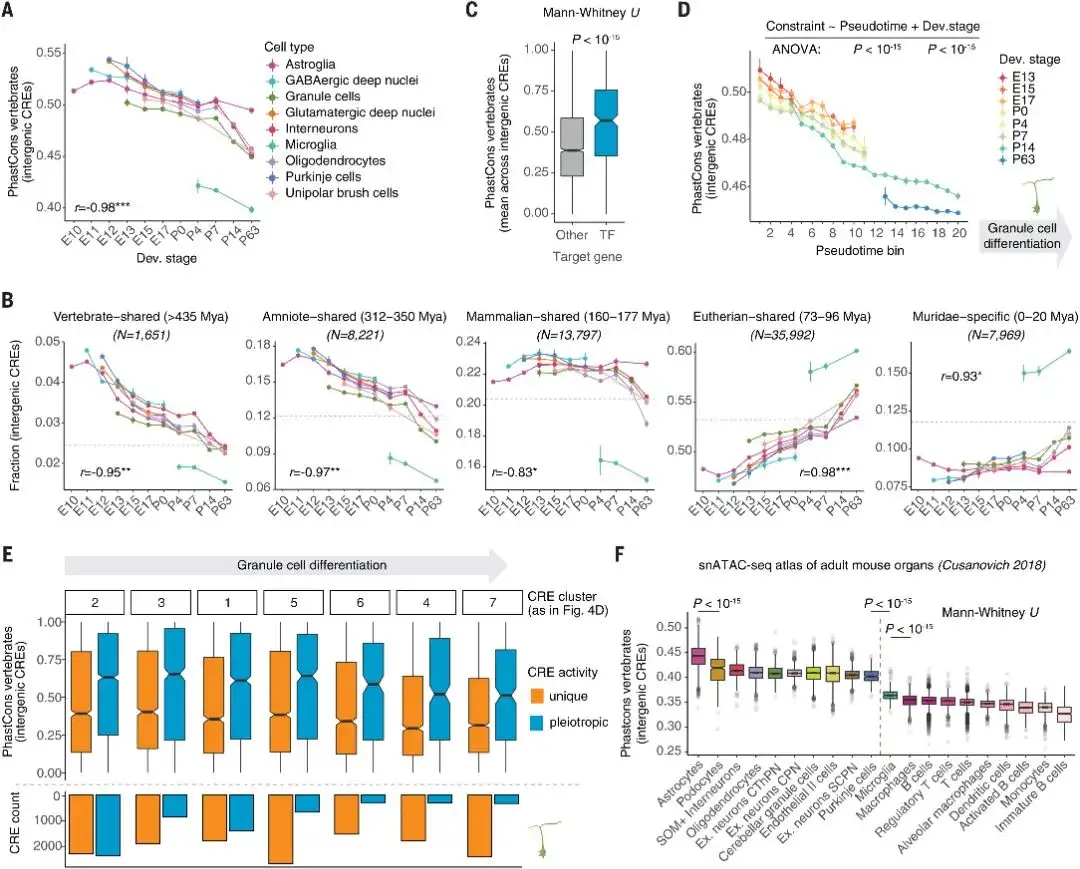
图 5 CREs的进化动态。
(图源:Sarropoulos I, et al., Science, 2021)
作者检测了灰色短尾负鼠(gray short-tailed opossum)小脑细胞的染色质可及性,以进一步评估序列约束的数据结果是否可以拓展到CRE活性的保守。作者获得了两个发育阶段(出生后第4天(P4)和P63(即成年阶段))的约20000个细胞的转录组学数据(图6 A),发现了一些相同的细胞类型以及多个共同标记性基因(真兽类(Eutherians)vs 有袋类(Marsupials))(图6 B-C)。而且,近50%的序列保守的CREs也表现出保守性活性,内含子和基因间CREs比启动子进化得更快(图6 D)。结果也表明,在哺乳动物进化过程中,大多数CRE保持着类似的特异性模式(图6 E-G)。总的来说,尽管在CREs出现和消失方面的调节活性的转换率比较高,但是对时空CRE活性的彻底再利用(周转)似乎是罕见的,至少在同一组织的细胞类型之间是如此。此外,在成年灰色短尾负鼠小脑中具有同源活性的基因在P4小鼠中都比表现出更高的保守性(图6 H-I)。 因此,这些结果(图6) 支持了细胞类型和发育阶段的CRE约束差异的结论。

图6 CRE活性在兽类哺乳动物中的守恒
(图源:Sarropoulos I, et al., Science, 2021)

图7 总结图:小鼠小脑细胞顺式调控元件
(图源:Sarropoulos I, et al., Science, 2021)
文章结论与讨论,启发与展望
综上所述,科学家们检测到相同细胞类型的细胞之间甚至匹配的分化状态之间的顺式调控元件(CREs)活性存在广泛的时间差异,表明细胞命运是通过共同的时间线索诱导的。在小脑的各类细胞中,调节保护的差异在成人中最为明显,其中小胶质细胞——大脑的免疫细胞——表现出最快的进化周转。相比之下,成熟的星形胶质细胞具有最保守的基因间CRE,不仅在小脑中,而且在其他成年小鼠器官中也是如此。这种差异可能是由于星形胶质细胞保持了神经祖细胞的某些特性,包括重新激活增殖的能力[6],和/或由于它们与多种细胞类型的桥接相互作用而产生的多效性限制大脑。
这项研究揭示了小脑细胞类型之间CRE活动的广泛时间差异,以及在发育和分化过程中CRE保守性的共同下降(图7)。鉴于小脑已成功用作研究细胞命运规范、神经发生和其他发育过程的模型系统,本文作者希望本研究中对调控元件的发育和进化动力学及其相互作用的观察也适用于一般的哺乳动物器官。
原文链接:https://doi.org/10.1126/science.abg4696