脊髓损伤是全球高致残率疾患,好发于青壮年,目前尚缺乏有效治疗。脊髓损伤后,受损平面及以下不仅仅丧失了大脑瞬时性的运动命令,而且脊髓内负责控制躯体运动节律和模式产生的中央模式产生器也遭受重创,最终导致运动功能丧失。目前脊髓损伤的研究主要聚焦于电刺激方式或/和特定生长因子相接合等修复大脑下行命令的策略,以及新材料的研发和应用等手段作为外源性支撑辅助策略,然而聚焦运动执行者的脊髓中央模式产生器神经环路在损伤后的重建机制仍鲜有报道。相较于成年鼠等哺乳动物脊髓再生修复能力低下,成年斑马鱼脊髓再生能力强,损伤后4-6周便可以恢复运动功能,是研究脊髓内源性修复机制的好模型。
2021年12月7日,同济大学宋建人团队在Nature Communications杂志上以题目“An injury-induced serotonergic neuron subpopulation contributes to axon regrowth and function restoration after spinal cord injury in zebrafish”发表了研究论文,该研究系统的解析了脊髓中央模式产生器在脊髓损伤后的修复规律,揭示了脊髓内源性的五羟色胺参与的促进神经轴突再生修复的机制,并找到了参与该修复机制的靶受体,为脊髓损伤的基础研究和治疗提供了新的思路。

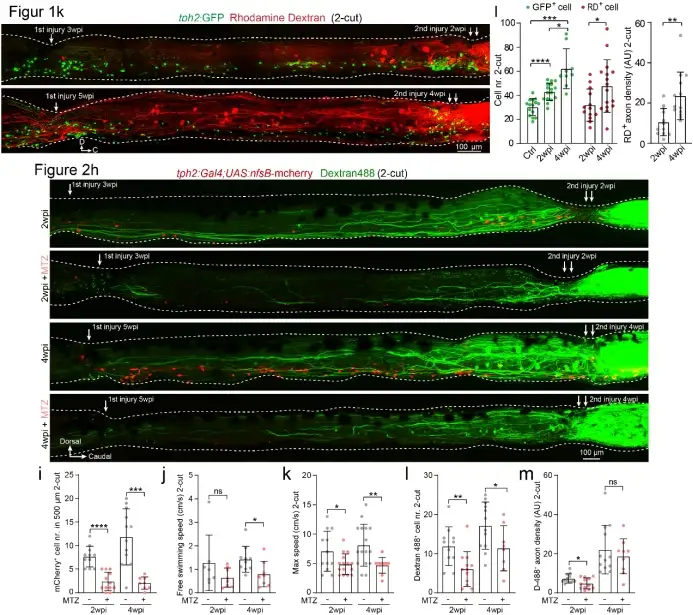
五羟色胺对于脊髓中央模式产生器的运行起到举足轻重的作用。研究者发现脊髓损伤后,在损伤节段处聚集了一群损伤诱导的新生脊髓内五羟色胺能神经元亚群,它们的数目和脊髓中间神经元轴突再生以及运动能力恢复呈现正相关。在研究者所开创的独立于大脑下行系统的脊髓二切模型中,同样验证了大量的新生五羟色胺能神经元的出现(Figure 1k),使用化学遗传法消除二切模型中新生五羟色胺能神经元后,脊髓运动的恢复受到影响(Figure 2h),证明新生五羟色胺能神经元亚群对脊髓损伤后修复和运动能力恢复具有促进作用。
研究者进一步对该群损伤诱导产生的五羟色胺能神经元的特性进行研究,通过电生理,双光子成像,基因表达分析,化学定量的方法发现:在同一损伤的动物脊髓内,与非损伤处的五羟色胺能神经元相比,损伤处五羟色胺能神经元自主发放高频率的动作电位(Figure 3b, c, d),表现出更强的钙信号波动(Figure 3f, j, h),释放更多量的五羟色胺(Figure 3i),以及展现转录组学上的特异性。暗示该群损伤诱导产生的特异性的五羟色胺能神经元通过其高强度度且持续活跃的电活动,为损伤处脊髓节段提供高浓度的五羟色胺微环境,促进受损的脊髓神经环路修复和运动功能的恢复。

研究者发现,斑马鱼脊髓全切损伤后,其运动能力可修复,但是脊髓中央模式产生器中的兴奋性谷氨酸能与抑制性的甘氨酸中间神经元的比例却发生极大的变化,由未损伤时1:1变为损伤后的8:1(Figure 4e, f),重建的运动神经环路与正常情况下相比发生了变化,尤其是兴奋性与抑制性神经元的构成。那么锚定再生能力更强的兴奋性神经元的修复机制便成为一个突破口。

通过基因测序手段,研究者发现轴突再生长穿过脊髓损伤处的谷氨酸能神经元上高表达htr1b受体基因。给予脊髓损伤的动物Htr1b受体激动剂可促进神经元的轴突再生和动物运动能力的恢复。采用CRISPR-Cas9的方法敲除斑马鱼体内的htr1b受体基因,在htr1b-/-脊髓损伤模型上,脊髓内谷氨酸能神经换的轴突再生受到抑制,并且动物运动功能恢复程度低。提示Htr1b受体是一种脊髓内源性五羟色胺参与轴突再生修复机制的作用靶点。
同济大学助理研究员黄春筱老师为本文第一作者,同济大学宋建人教授和关娜副教授为本文共同通讯作者。本研究得到同济大学医学院章小清教授和中科院神经科学研究所何杰研究员的指导和支持。得到国家重点研发计划、国家自然科学基金、上海市科委重大专项、上海市自然科学基金、同济大学附属上海市第四人民医院、同济大学脑与脊髓临床研究中心、同济大学医学院脑功能与人工智能转化研究所等资助。
文章链接:
https://www.nature.com/articles/s41467-021-27419-w.pdf
原文链接:
https://www.nature.com/articles/s41467-021-27419-w