
01
遇见/摘要
手性胺可以通过使用两种催化剂体系在卡宾中插入N-H键来制备,该系统基于过渡金属的卡宾转移催化剂和手性质子转移催化剂以实现立体控制。血红蛋白可以催化卡宾 N-H键插入,但在充满质子源的活性位点中进行不对称质子化反应具有挑战性。本文作者通过使用工程化P450酶P411 L7_FL催化卡宾N-H插入以高活性和对映选择性制备α-氨基内酯衍生物。P411 L7_FL作为双功能催化剂,在活性位点以高立体选择性诱导卡宾转移并促进随后的质子转移反应。此外作者通过计算研究揭示反应机制并阐明活性位点残基对反应活性和对映选择性影响的关键原因。
02
遇见/内容
不对称N-H插入反应常见策略是使用过渡金属催化剂发生卡宾转移反应,并使用手性质子转移催化剂(PTC)进行立体诱导(图1a)。本文作者通过借鉴双催化剂策略,提出利用生物催化方法分别执行卡宾产生以触发胺的亲核进攻和在酶活性位点形成叶立德后立即选择性诱导质子转移两种不同的功能(图1b)。

L7_FL 的初步筛选和鉴定。作者以内酯重氮1和N-甲基苯胺2a反应生成α-氨基内酯产物3a为起始反应研究酶促卡宾N-H插入反应。作者首先筛选40种血红蛋白突变体,其中FAD结构域截短的P411突变体L7产率和e.e.值较高,全长P411(L7_FL)进一步提升酶的催化性能(图2a, 2b)。在从L5到L6进化过程中,单突变A264S对N-H插入反应对映选择性产生重要影响,作者基于L6_FL制备五种突变体,发现将丝氨酸突变为体积较小的氨基酸活性保持但选择性降低,作者推测丝氨酸亲水侧链可能影响对映选择性(图2c)。

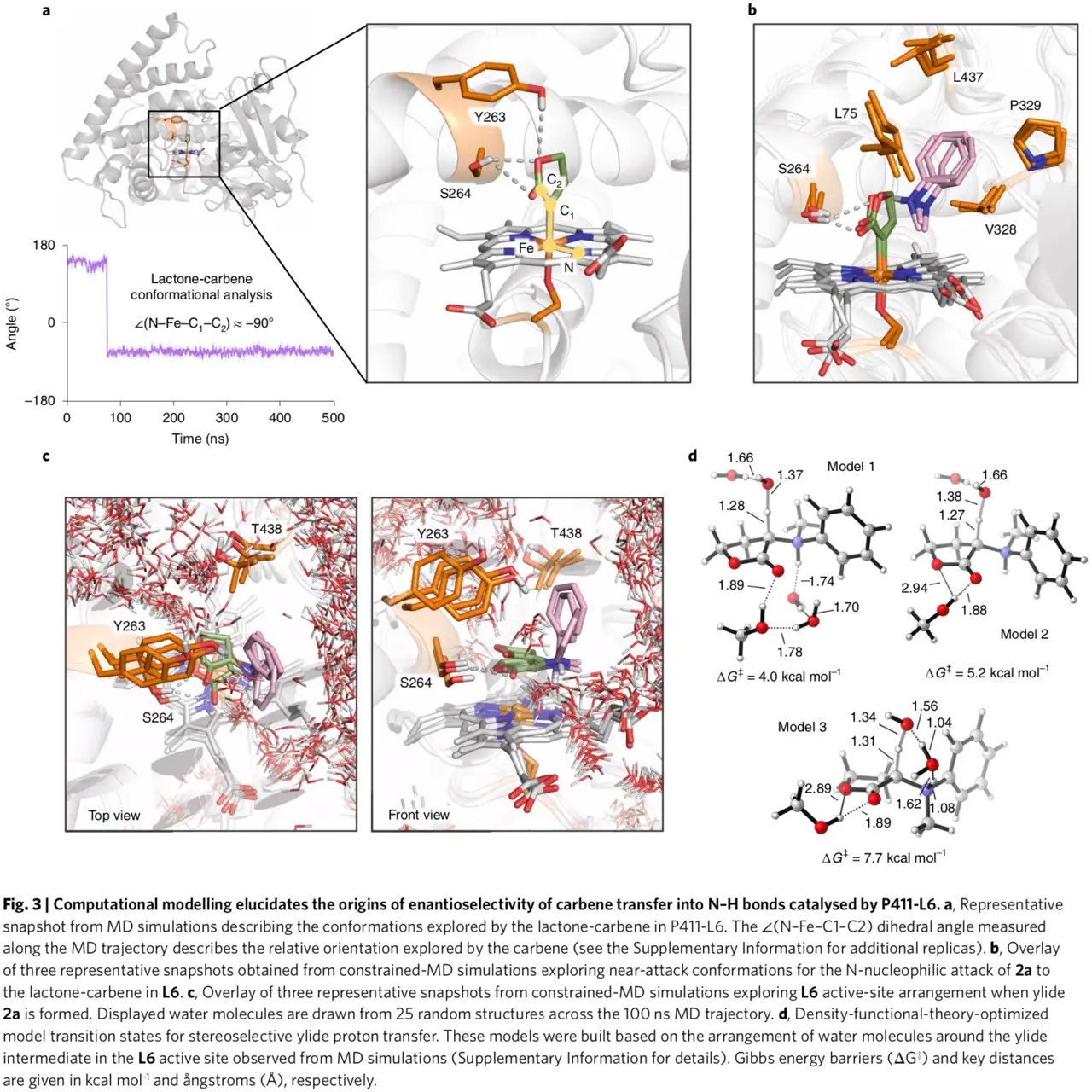
计算模拟。接下来作者进行计算研究以阐明反应机理和S264在不对称卡宾N-H插入中的作用。分子动力学模拟结果表明内酯通过与S264侧链形成氢键作用稳定,S264不仅控制卡宾取向而且提高卡宾反应性(图3a)。下一步作者模拟底物胺2a插入到卡宾以及随后在L6活性位点中形成叶立德中间体,结果如图3b所示进攻构象的胺底物通过疏水相互作用稳定进而与内酯-卡宾复合物反应,此外活性位点口袋形成两个水分子通道(图3c)。密度泛函理论计算表明从铁离子中解离出来后叶立德中间体与水分子迅速反应,从而在酶活性位点实现立体选择性质子重排:一个水分子从内酯环的上部(pro-S面)质子化C位的叶立德,另一水分子使胺基发生去质子化(图3d)。以上结果表明通过对映选择性形成叶立德和水分子在活性位点精确定位促使酶选择性催化实现N-H插入反应。
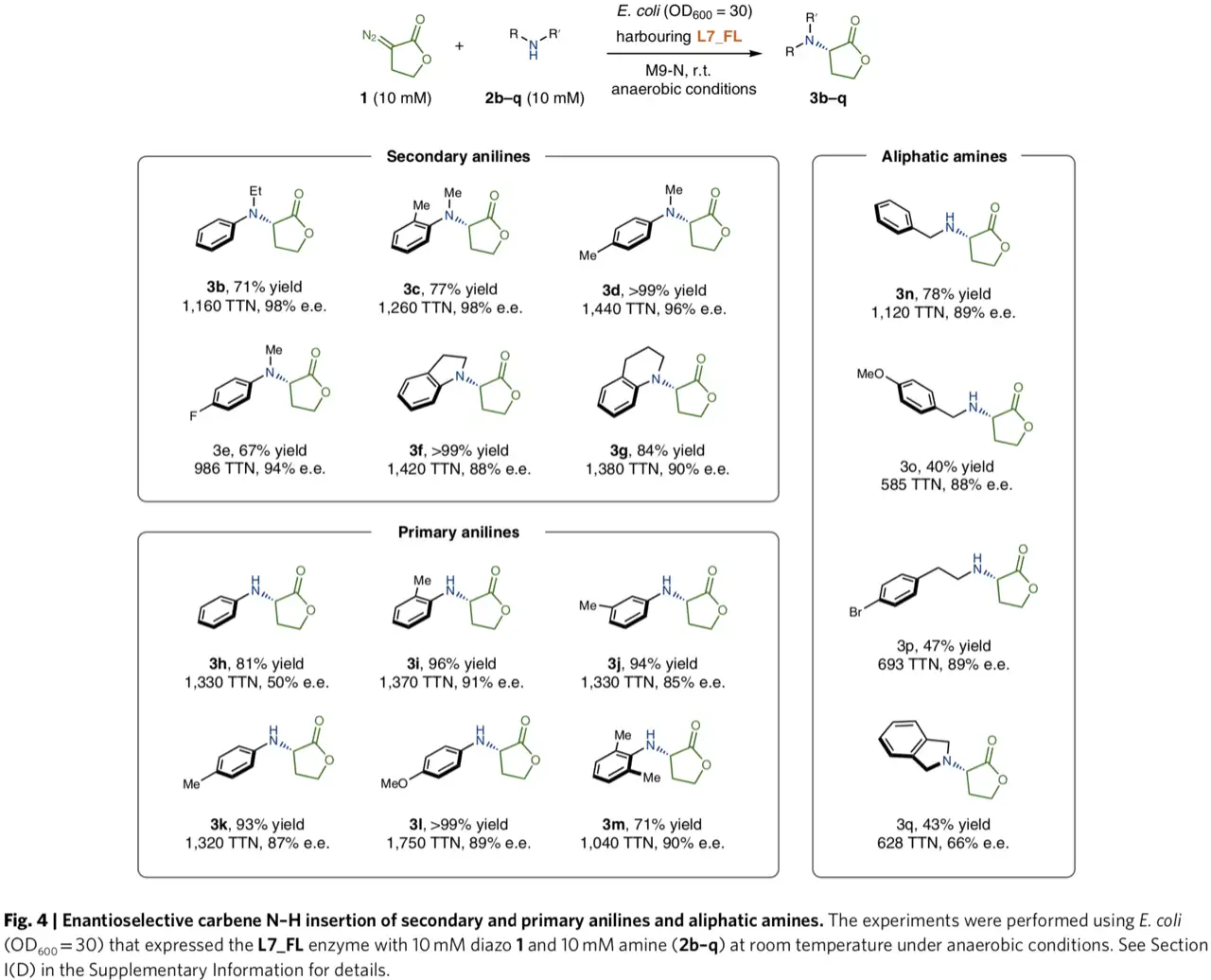
丰富L7_FL底物谱。作者设想具有双功能催化活性的L7_FL可以通过立体控制将内酯-卡宾转移到其他胺类底物。作者测试不同类别的苯胺类化合物和脂肪胺2b-q分别与内酯重氮1反应(图4)。
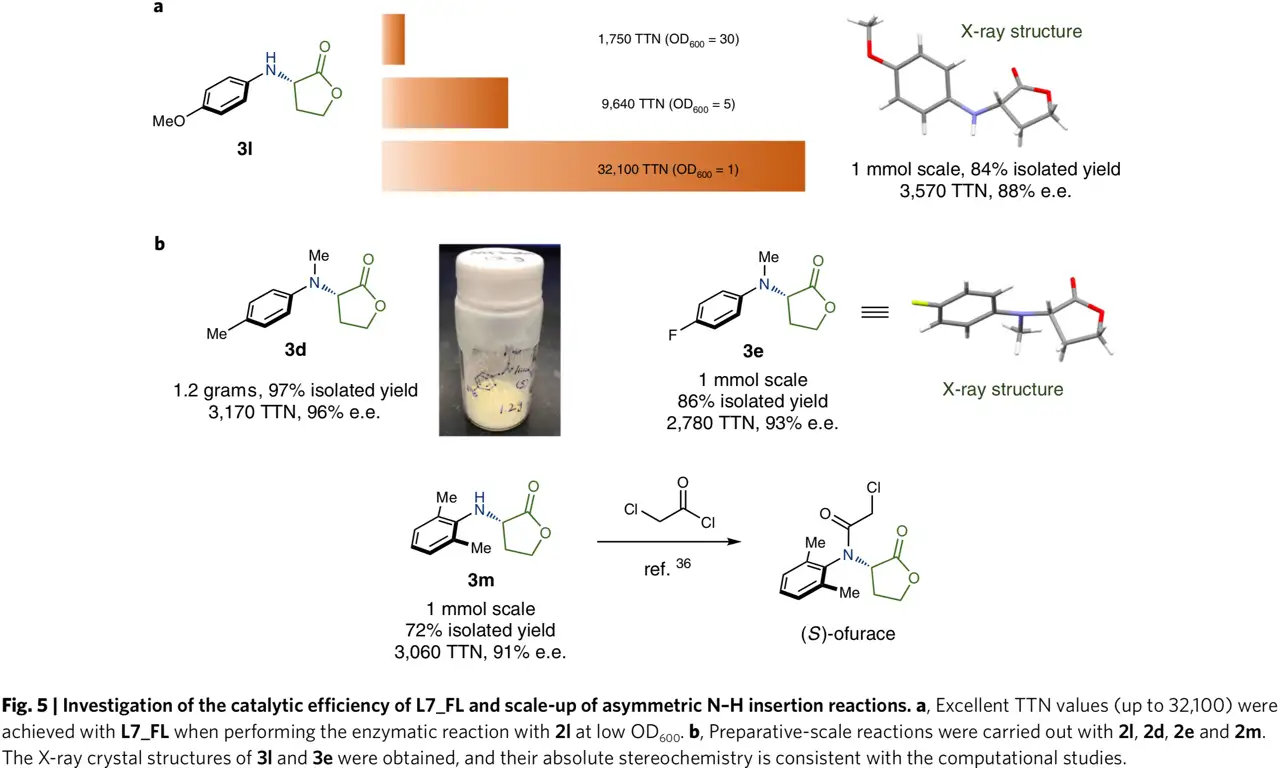
L7_FL的制备规模反应。降低全细胞催化剂的量后并没有导致产物显著减少(图5a)。此外作者以2d作为胺源发生N-H插入反应以克级规模制备3e,并应用于杀菌剂ofurace(S)-对映异构体的合成中(图5b)。
总之,本文作者通过生物催化策略实现对映选择性地卡宾N-H插入反应以制备α-氨基内酯衍生物。工程化的P411 L7_FL作为双功能生物催化剂催化内酯-卡宾向底物胺转移,并通过水分子发生质子重排实现立体控制。此外作者通过计算研究阐明264位丝氨酸残基对反应活性和对映选择性的关键作用。通过杀菌剂ofurace的高效合成展现出将该策略应用于手性胺制备的可行性。