由于在有水的情况下实现粘合非常具有挑战性,因此对生产出用于潮湿环境(例如,用于手术或牙科治疗)的有效粘合剂是一个具有巨大前景的领域。众所周知,贻贝在聚合物聚合物材料具有广泛的应用,包括自修复材料、先进涂层,尤其是仿生粘合剂。贻贝是一种在海岸边生存的动物,一直承受着海浪冲击波、捕食鸟类和交配斗争等外界风险。面对这些挑战,许多贝类物种通过粘在岩石上或者彼此之间粘在一起确保安全。贻贝开发了可在潮湿环境中发挥作用的粘合剂。贻贝粘合体系是基于蛋白质的,由粘在表面的胶块(或圆盘)和将这种粘合剂连接到动物组织的线组成。主要有两步将这些蛋白质转化为粘合剂。蛋白质经过翻译后修饰以生成儿茶酚侧链。这些3,4-二羟基苯丙氨酸(DOPA)残基通过几种类型的化学反应和键产生交联。此外,这些DOPA蛋白与金属离子结合。
但是直到现在,贻贝产生粘合剂的具体机制一直笼罩在神秘之中,因为一切都发生在贻贝足部内部,看不见。尚不清楚这种金属-蛋白质系统是如何形成的,以及有机-无机相互作用如何影响整体特性?

鉴于此,来自于加拿大麦吉尔大学的MatthewJ.Harrington副教授课题组经过在该领域的十年工作,通过使用多种方法的组合,包括显微计算机断层扫描(micro-CT)、光学显微镜、电子显微镜、X射线荧光显微镜和共聚焦拉曼光谱成像,终于成功地揭示了贻贝制造水下粘合剂的细胞机制。海洋贻贝使用钒和铁来构建其基于蛋白质的粘合剂。相关研究成果以题为“Microfluidic-like fabrication of metal ion–cured bioadhesives by mussels”发表在最新一期《Science》上。

【贻贝高粘合性机理】
作为动态承重交联的蛋白质-金属配位配合物的发现和表征(图1A)引发了受贻贝启发的金属聚合材料的发展。足丝由通过将大约10种不同的蛋白质前体分泌到称为贻贝足的专门分泌器官的凹槽中而单独产生的蛋白质纤维组成(图1B)。在底部螺纹的远端,称为斑块的扁平圆盘在海水条件下几乎牢固地粘附在任何表面上。生化和功能研究表明,大多数斑块蛋白含有高浓度的3,4-二羟基苯丙氨酸(DOPA),其中含有酪氨酸翻译后羟基化产生的儿茶酚基团。DOPA通过各种物理和化学相互作用与不同的表面化学物质相互作用,在粘附中起着至关重要的作用。此外,通过形成DOPA-金属配位键(图1A),斑块得到固化和机械稳定,在斑块蛋白之间提供强大但可逆的内聚相互作用。足底斑块在几分钟内形成,流体蛋白质前体的酸性分泌物会在脚尖腹侧形成一个小草皮,称为远端凹陷(图1B、1C)。近50年前发表的初步研究表明,斑块囊泡通过称为纵向导管(LDs)的纤毛通道运输到远端凹陷处,该通道从斑块腺体延伸出来。图1C显示了一个复杂的LDs网络,它穿过斑块腺体,会聚在形成斑块的远端凹陷处。图1D-I表明LD微通道具有直径在10到100μm之间的圆形横截面,由具有许多纤毛和微绒毛的独特柱状上皮组织形成,LDs被包含大量球形斑块囊泡的细长斑块腺细胞包围。拉曼光谱成像在LDs周围的亚微米斑点中识别出囊泡外DOPA-金属配位的存在(图1E、1J)。
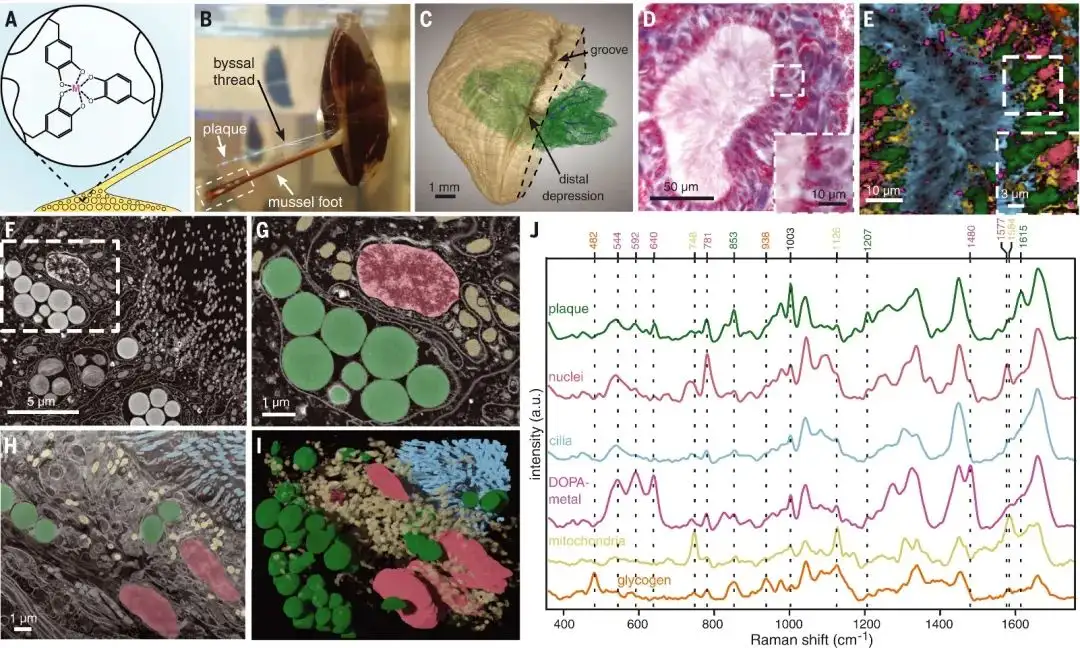
图 1. 在贻贝足中发现的LD的特征
【金属离子的作用】
作者使用自动金相分析(AMG)、微X射线荧光(μXRF)和具有能量色散X射线光谱的STEM(STEM-EDS)进一步研究金属离子可能的储存和分泌。AMG是一种极其敏感的组织学染色方法,其中重金属离子首先转化为金属硫化物,然后在对苯二酚的存在下还原银离子。在腹侧沟(形成螺纹的地方)和直接在LD周围观察到阳性AMG染色(图2A),证实了这些区域中存在重金属离子。连续的连续切片显示出明显的铁和钒存在于不同贻贝脚的LD周围(N=3)(图2B)。STEM-EDS揭示了钒和铁的存在,集中在LD周围的明亮(高电子密度)亚微米级颗粒中,作者在此将其称为金属存储颗粒(MSP)(图2C)。根据它们的大小和分布,MSP可能与使用共焦拉曼光谱映射在LD周围检测到的亚微米粒子相同(图1E和2D)。此外,由于存在特定于DOPA-金属配位的拉曼共振峰(图2E),这些发现表明MSP中的金属很可能与有机成分相关,以双齿方式与儿茶酚基团配位。
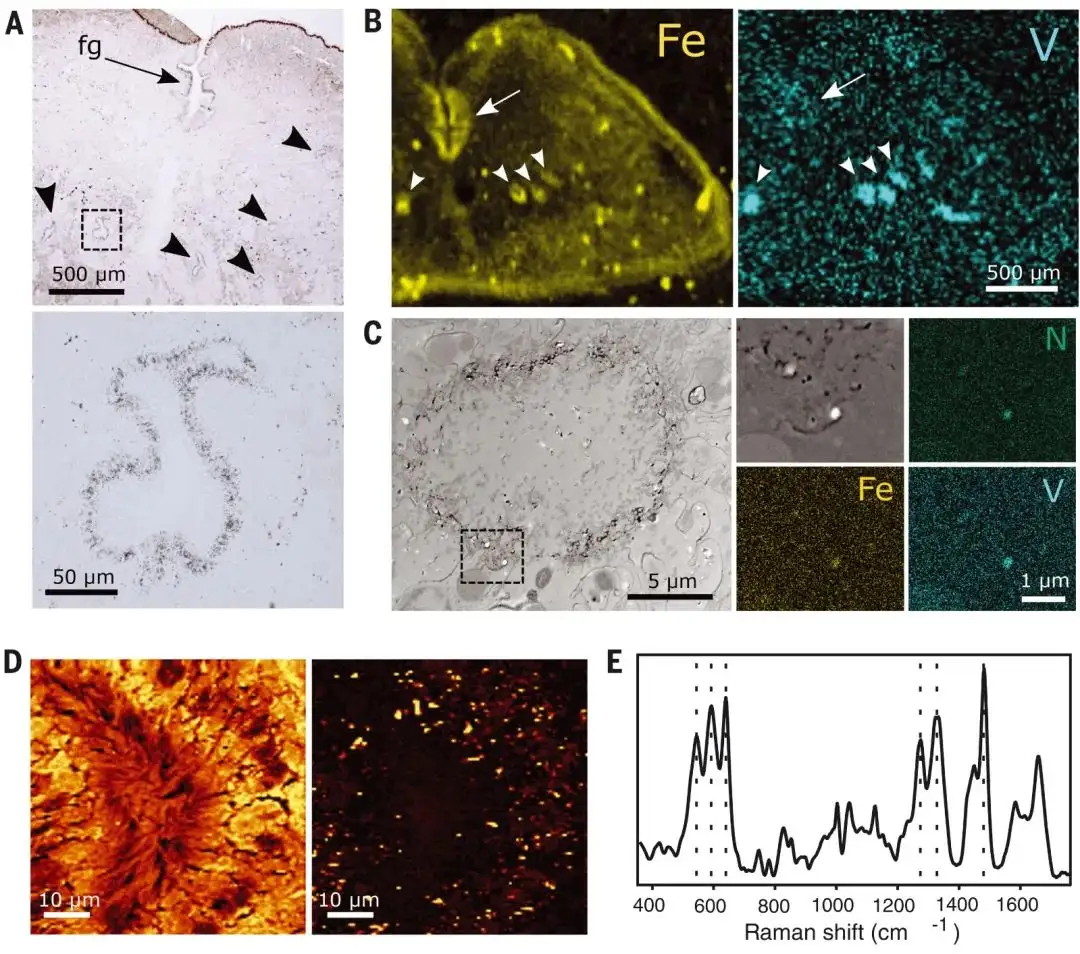
图 2. LD周围存储的金属
【斑块蛋白的分泌与作用】
作者在不同的时间点冻结分泌过程,并使用组织学成像、FIB-SEM和共焦拉曼光谱成像分析组织。诱导足的组织学成像显示,斑块囊泡被分泌到LDs中,在那里它们合并成凝聚的液体团块,该团块始终均匀地染色,并且在靠近远端凹陷处尺寸增加(图3A)。FIB-SEM重建显示大量囊泡通过纤毛分泌并在管腔中混合在一起(图3B)。

图 3. LDs中斑块蛋白的分泌
【MSP在LDs中的作用】
诱导斑块的拉曼成像提供了对MSP分泌及其与斑块蛋白混合的洞察(图4A)。图4A-4C表明:(i)用于形成斑块的Fe和V离子被贻贝积极积累并分别储存在足部来自与含有儿茶酚的分子复合的小颗粒(MSP)中的斑块蛋白。(ii)斑块形成通过类似微流体的过程进行,在该过程中,储存的前体蛋白和MSP通过纤毛排列的微通道的多重网络进行部署、运输和主动混合。(iii)当分泌的内容物通过微通道时,MSP释放它们的金属离子,这些金属离子遍布整个新生斑块,然后它们与斑块蛋白中的DOPA残基配位。

图 4. MSPs在LDs中的分泌
【总结】
研究人员通过在亚细胞水平上收集信息,发现在贻贝足内有微米级的通道(直径从1/10到人类头发的全宽)将聚集在一起的物质汇集在一起,形成胶水。小囊(囊泡)中的浓缩流体蛋白质被分泌到通道中,在那里它们与金属离子(铁和钒,从海水中吸收)混合。金属离子也储存在小囊泡中,在精心定时的过程中缓慢释放,最终将流体蛋白质固化(或硬化)成固体胶水。这项研究通过了解物理化学环境如何触发流体到固相的转变,可能会激发在环境友好条件下运行的3D打印技术的发展。