前言
缺血性中风是由于脑部血管阻塞引起的脑血管血流减少,供氧和营养物质不足,进而引起脑细胞死亡和神经细胞的突发性功能丧失的脑血管疾病。目前,仅有一个获批的生物制剂组织型纤溶酶原激活剂(tPA)用于中风治疗,是中风治疗的金标准,但仅在中风发作3-5h时间窗内给药有效,还没有新的中风治疗药物上市。
肽酶神经溶素(Peptidase neurolysin, Nln)是一种锌金属肽酶,脑卒中后Nln的上调是一种重要的内源性脑保护机制,已经成为缺血性中风的治疗靶点。2021年8月26日,Paul C. Trippier等综合利用虚拟筛选、结构优化等策略首次报道了具有组氨酸结构骨架的Nln小分子拟肽激活剂,表现出微摩尔水平活性,脑渗透性、选择性、脑稳定性等优点,具有进一步开发为药物的潜力,相关内容发表于JMC上。
肽酶神经溶素介绍
肽酶神经溶素(Peptidase neurolysin, Nln)是一种锌金属肽酶,属于肽酶家族(M3家族),参与处理神经元和神经胶质细胞表达的细胞外生物活性肽,即能够降解各种神经肽。肽酶神经溶素广泛分布于中枢神经系统并主要以可溶形式存在于细胞质中。Nln是急性神经退行性疾病中内源性脑保护机制的关键组成部分以保护脑损伤,脑卒中后Nln的上调已被确证为一种重要的内源性脑保护机制,作为缺血性中风治疗的靶点。在卒中小鼠模型中,Nln的过度表达导致卒中预后的显著改善,而药物抑制Nln则加重病情,因此激活Nln是一个具有潜力的缺血性中风治疗靶点。Nln小分子抑制剂早有报道,但没有相关的激活剂报道。
首个Nln激活剂的发现
作者首先以全长鼠源Nln铰链区(PDBID: 1I1I)作为靶标,对来自NCI Developmental TherapeuticsProgram (DTP)文库的139725个类药性分子进行对接虚拟筛选,并对得分TOP40的化合物进行分析,发现具有组氨酸骨架的二肽化合物具有Nln激活活性。基于半数激活浓度A50和最大激活百分数Amax的分析得到四个包含芳环的二肽Hit化合物1-4,其中化合物1的A50=85.5 μM,Amax=465%;化合物2的A50=126.5 μM,Amax=498%;化合物3的A50= 74.5 μM,Amax = 442%;化合物4的A50=39.4 μM,Amax=430%。

图:虚拟筛选及Hit化合物的发现
构效关系研究
作者以A50和Amax作为生物活性的表征指标,其中Amax参数的100%代表正常Nln周转总量,主要基于A50进行化合物活性评价同时考虑Amax的合理性,例如5c的Amax是700%,但A50为227μM,在人脑中明显不能达到这一浓度,因此舍弃。
基于四个Hit化合物的结构分析发现,左侧组氨酸片段相对保守,作者假设这是关键药效团,因此保持组氨酸片段不变,改变右侧氨基酸片段以进行构效关系研究。右侧酪氨酸取代的化合物1活性稍微低于苯丙氨酸取代的化合物3,苯环取代可能增加活性,色氨酸取代的化合物4活性最高,表明杂环和/或更多芳香性取代可能提高活性。
靶向Nln必须入脑发挥作用,作者以多参数优化(MPO)评分和配体亲脂性效率(LLE)参数评估化合物的血脑屏障(BBB)渗透能力。化合物1-4 的MPO分别为4、4、4.1、4,发现四个化合物的BBB渗透率很低,因此化合物MPO最好大于5;以LLE作为化合物类药性评价参数,如果LLE超过5,并结合log P考虑,通常认为该分子是“类药物”。作者的设计策略为修饰对BBB渗透不利的氨基酸片段、增加脂溶性、改变末端芳环取代/杂环以及探索组氨酸手性以确定优势异构体。

图:系列化合物结构及体外活性评价
确定结合Nln的必需药效团。设计化合物1的两个氨基酸变换位置化合物4a,其活性丧失,表明组氨酸以C端形成酰胺键对Nln激活至关重要;Boc封闭组氨酸的伯氨获得4b,移除组氨酸氨基获得9c,两者活性均丧失,因此这一位置的伯氨或至少一个氢键受体对于Nln激活是必需的,因此组氨酸是关键药效团。移除3的羧酸片段得到4c,其A50提高但Amax降低,MPO增为5,表明BBB渗透增加,但LLE降低,证明进一步优化获得高活性化合物的可能性。
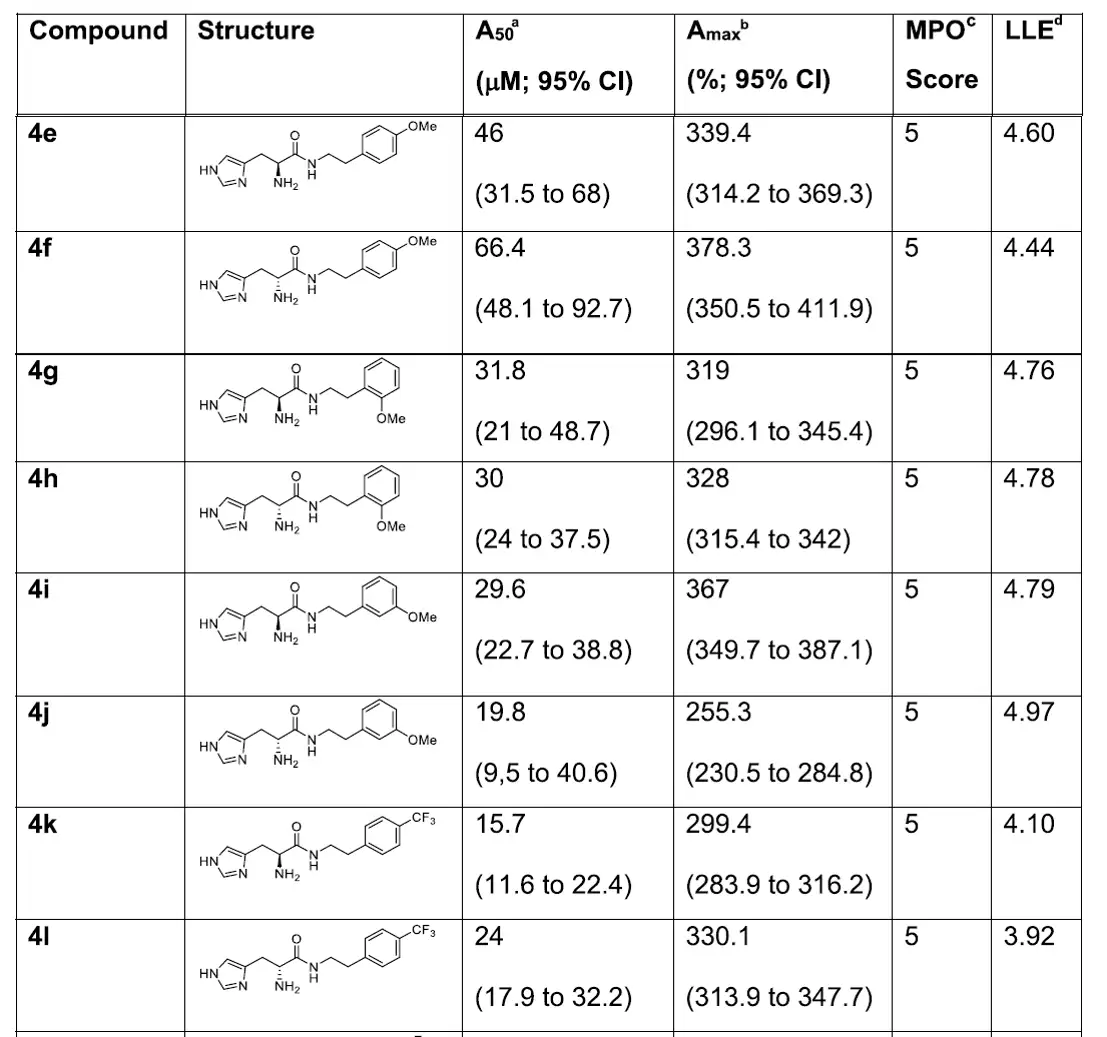
图:系列化合物结构及体外活性评价
探索组氨酸立体化学对活性的影响。包含D组氨酸的4d和L组氨酸的4c具有类似活性,并且大多数的单环衍生物具有类似结果。但对硝基苯基化合物4o和4p的A50存在约两倍的差异,Amax相似,两者MPO均低于其他化合物。5o的A50是5n的大约两倍,Amax相似,6a活性低于6b, Amax相当。双环化合物10c和10d的立体化学与活性之间同样没有相关性,并且外消旋化合物10c/d的活性中间值在单体活性置信区间内。虽然没有获得单一优势异构体,但作者认为立体化学可能带了大约4倍活性差异,于是后面的设计均同时考虑两个异构体。

图:系列化合物结构及体外活性评价
以甲氧基取代探索末端苯环取代位置的影响。对位取代活性最低(4e和4f),邻位和间位取代活性增加(4g和4h,4i和4j);对位取代吸电子的CF3活性明显增加(4k和4l);对位吸电子程度较低的F取代活性保持相似(4m和4n);对位硝基取代活性增加,LLE大于5但MPO小于4(4o和4p)。在苯环对位引入第二个苯环获得的化合物4q和4r是目前最有效的化合物A50为9.5μM和11.7 μM,Amax为258%和269%,然而联苯的亲酯性导致LLE降低为3.3和3.2。

图:系列化合物结构及体外活性评价
增加酰胺键周围的空间位阻以提高酰胺键稳定性。将4c的亚乙基缩短为亚甲基得到5a活性保持,但Amax更低。基于5a探索苯环取代基位置的影响,活性邻位>间位>对位(5a-5g);吸电子的CF3取代活性增加,并探索取代位置的影响,活性间位>对位>邻位(5h-5m)。对位F取代的5n和CF3取代活性类似。对位SCF3的5r活性与5h相似,D组氨酸的5s活性提高。
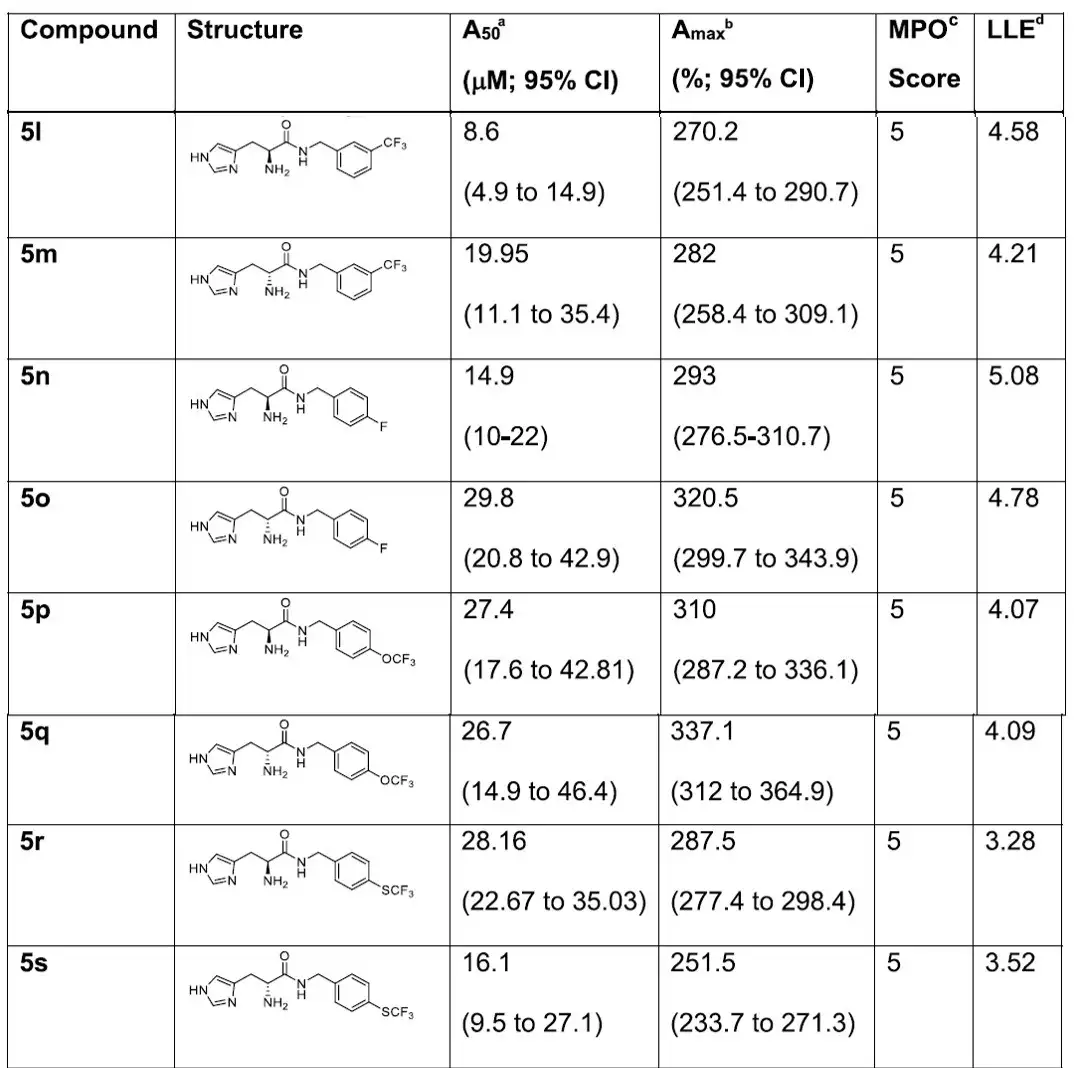
图:系列化合物结构及体外活性评价
完全切除酰胺键和右侧芳环之间的linker获得芳酰胺L-6a,其MPO为5,LLE为4,D-6b异构体活性更高。与4c和5a相比,增加linker长度获得的7a对活性没有明显影响。引入4C烷基链linker获得的L-8a活性降低,而D-8a保持活性。因此,1-3个C的linker是最合适的,表明化合物占据Nln内有限的结合口袋。

图:系列化合物结构及体外活性评价
活性最高的Hit化合物4的双环结构增加酰胺键周围位阻,具有提供更好稳定性的潜力。移除4的羧酸片段获得的外消旋体9a活性增加,Boc封闭氨基得到的9b和除去自由氨基的9c活性丧失,进一步证明了组氨酸作为Nln激动的关键药效团。相比于9c,9d和9e活性明显提高,LLE更高,MPO为4.9,其中消旋体活性与单体类似,表明代谢消旋化不会明显影响活性。

图:系列化合物结构及体外活性评价
探索删除双环系统的杂环的影响。将吲哚环变为萘环获得的9f和9g活性降低,表明吲哚N对于靶标结合具有一定作用。除去linker的一个C原子获得的10a和10b的活性保持。甲基萘环位置变换获得的10c和10d对活性没有明显影响。删除linker后再引入N原子得到11a和11b,是目前活性最好的化合物,两者平均Amax为285%,MPO和LLE大于5,立体位阻酰胺稳定性增加,同样外消旋体11a/b与单体具有相等的A50。

图:系列化合物结构及体外活性评价
总之,组氨酸以C端形成酰胺键,保留自由氨基,是该骨架的关键药效团,和氨基相连的C立体化学并非关键。除去hit羧基活性保持,但BBB渗透增加,缩短酰胺键与末端芳环的linker长度活性增加。最终发现了4o、4q、5l、9d、10c、11a、11b具有低微摩尔的A50值,高的Amax值,高的类药性LLE值,以及高的稳定性。
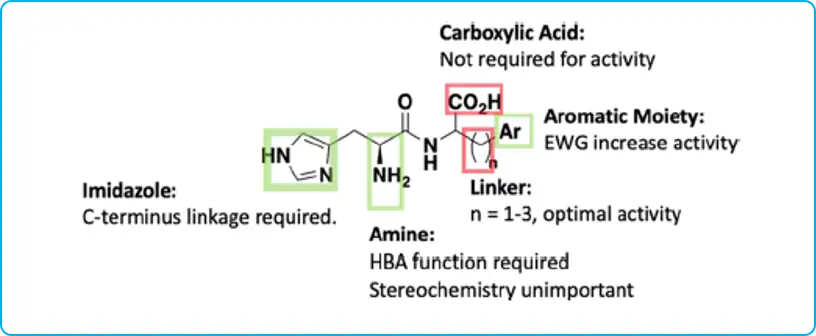
图:构效关系总结
体外代谢稳定性
以较低微摩尔A50和Amax大于250%的化合物1、4、9d、10c、11a进行体外血浆和脑匀浆稳定性实验。

图:化合物在鼠血浆和脑匀浆中的稳定性
在鼠血浆中,具有不稳定酰胺键的化合物1的半衰期仅为34min,酰胺键周围存在立体位阻的化合物4半衰期大于300min,证明通过引入双环和减短酰胺键和右侧芳环片段之间的linker以提高酰胺键周围位阻,进而提高酰胺键稳定性具有可行性。去掉右侧芳环片段羧基的化合物9d和10c半衰期明显增加,均大于1000min;11a则具有中等的半衰期,为248min,优于化合物1,而与化合物4相似。1和4在鼠脑匀浆中均不稳定,半衰期仅为1和1.6 min,而9d、10c、11a的半衰期为66、80、182min,稳定性大幅度提高。
血浆和脑蛋白结合
利用快速平衡透析系统(RED)测试血浆和脑蛋白结合程度并计算化合物的未结合分数。

图:化合物在鼠血浆和脑匀浆中的蛋白的未结合分数(fu)
在鼠血浆中,化合物4具有最高的未结合分数,而1比4具有更高的蛋白亲和力。9d与1具有相似的未结合分数,10c和11a的未结合分数则更低。由于1和4在脑匀浆中代谢不稳定,没有进行脑匀浆蛋白结合分析。在脑匀浆中10c和11a未结合分数相似,而9d具有最高的未结合分数。
体外血脑屏障渗透性
为了确定血脑屏障(BBB)渗透性,将化合物1、4、9d、10c、11a加到已建立的共培养系统腔室,并对它们通过细胞的进行性转移进行监测。
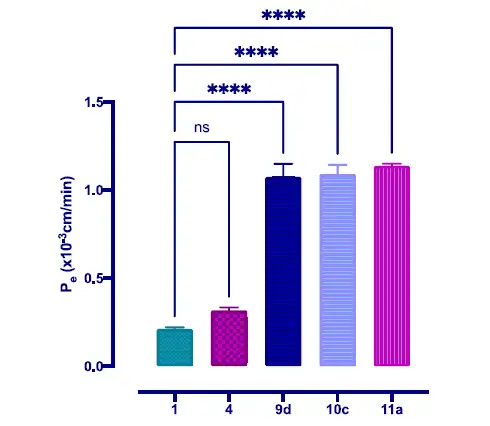
图:在37℃共培养BBB模型中,10μg/mL化合物从顶层到底部的转运情况,Pe为渗透系数,指单位时间内的清除体积,重复3次。
与化合物1和4相比,Nln拟肽激活剂从顶端到基底外侧的转运量显著增加,9d,10c和11a的Pe值分别为1.07±0.12×10−3,1.09±0.09×10−3,1.14±0.02×10−3cm/min,是1和4(0.21±0.01×10−3和0.32 0.03×10−3cm/min)的4−5倍,表明BBB渗透性显著增加。
肽酶选择性
利用八点浓度响应实验测试化合物9d,10c,11a对与Nln高度相关的肽酶Peptidases thimet oligopeptidase(TOP)、Neprilysin(NEP)、Angiotensin-convertingenzyme 2(ACE2)和ACE的抑制情况。化合物10c和11a对TOP没有明显抑制,9d仅在300μM浓度时有抑制(a-c);三个化合物对NEP均没有明显抑制(d-f);高浓度时,9d和11a对ACE2有抑制,10c在300μM浓度下也没有抑制;9d和11a在高浓度下抑制ACE,10c在测试的最大浓度下也没有抑制(j-l)。结果表明化合物9d,10c,11a对Nln具有高度选择性。
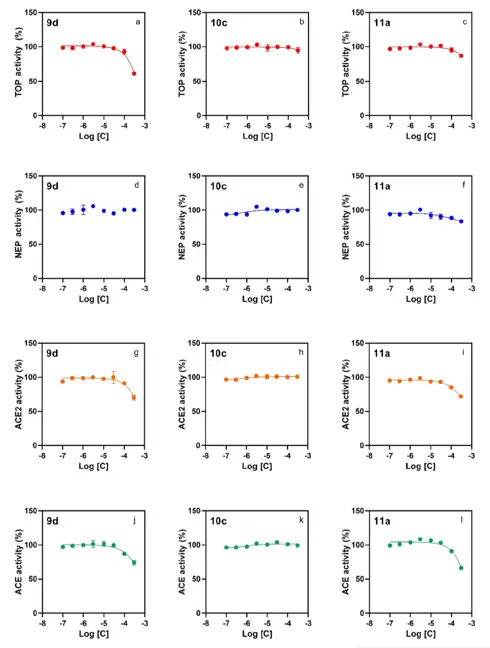
图:化合物对肽酶TOP、NEP、ACE2、ACE的影响
内源性底物降解分析
为了验证化合物对Nln的内源性底物降解的增强效应,作者测试了9d,10c和11a对降解缓激肽(BK)和神经降压素(NT)的影响,比如Nln催化BK-(1-5)和NT-(1-10)形成。结果表明化合物能够浓度依赖性的增加BK和NT的降解(a和b)。

图:化合物对Nln底物BK和NT降解的影响
总结
作者通过虚拟筛选获得四个hit化合物,并进行初步构效关系研究,证明组氨酸片段是关键药效团,特别是自由氨基的存在至关重要;分子手性对生物活性没有明显影响;组氨酸C的酰胺键和末端芳环之间为1-3个C的linker是适宜的;末端芳环也是药效团并且对吸电子取代基、给点电子取代基、不同取代位置以及杂环取代均是耐受的。
最终发现了化合物9d,10c,11a,相比于Hit化合物,活性提高超过30倍,鼠脑稳定性提高65倍,相比于TOP,NEP,ACE2,ACE的选择性增加,脑渗透性增加5倍,同时增强Nln对内源性底物BK和NT的降解。

图:Nln小分子拟肽激活剂的发现
化合物11a是首次报道的Nln拟肽小分子激活剂,后继作者将进一步探索组氨酸片段和酰胺键的构效关系,以基于该骨架进一步优化获得用于治疗神经退行性疾病的小分子,对于Nln小分子激活剂的开发具有重要参考意义。
参考文献:
Md.Shafikur Rahman,Paul C. Trippier,et al. Discovery ofFirst-in-Class Peptidomimetic Neurolysin Activators Possessing Enhanced BrainPenetration and Stability.J. Med. Chem.2021, 64, 12705-12722.
本文版权归原作者所有,文章内容不代表平台观点或立场。如有关于文章内容、版权或其他问题请与我方联系,我方将在核实情况后对相关内容做删除或保留处理!联系邮箱: yzhao@koushare.com