最近,复合材料研究所的李万万研究员科研团队在纳米生物技术研究领域取得了重要进展。研究成果以“Antiangiogenesis Combined with Inhibition of the Hypoxia Pathway Facilitates Low-Dose, X-ray-Induced Photodynamic Therapy”为题,在国际著名学术期刊《ACS Nano》发表。该研究报道了一种高效的双-核卫星纳米平台,可以实现对纳米闪烁体、光敏剂和血管新生抑制剂的分离可控装载,最终促成了X射线激发光动力治疗和抗血管新生治疗的协同疗法。由于该独特结构在提升能量传递效率、提高药物装载量和实现药物可控释放方面的优势,只需极低的辐照剂量便可实现深部肿瘤的高效清除。

由于X射线极高的组织穿透深度,X射线激发的光动力疗法(XPDT)在深部肿瘤的微创治疗方面具有独特的优势。然而,这一新兴技术的发展当前正面临着一些限制,如充当换能器的闪烁体在纳米尺度的性能下降;闪烁体和光敏剂之间不合理的结构设计导致的低能量传递效率;以及肿瘤乏氧引起的血管新生、转移、代谢变化等。
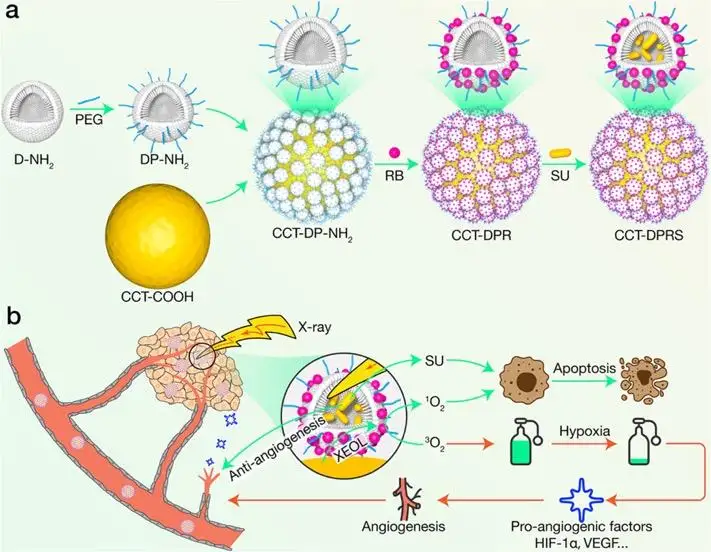
研究工作的设计思路
为此,李万万研究团队从这三个方面进行了改进。首先,通过共掺杂策略合成出了具有高闪烁发光效率的纳米闪烁体(14 nm)。在X射线照射下,该纳米闪烁体发出肉眼可见的强绿色荧光。同时,该闪烁体在生理环境下具有极高的光和化学稳定性。其次,引入了树状大分子作为基本框架,修饰在纳米闪烁体表面,构建了具有核-卫星结构的纳米平台。树状大分子具有双载特性,即内部的空腔和表面的官能团都可以作为装载平台,大大提高了药物装载的种类和容量。同时,树状大分子尺寸约3.6 nm,显著提升了从闪烁体到所装载的光敏剂之间的能量传递效率。最后,由于XPDT会进一步加剧肿瘤部位的乏氧状况,为了阻断肿瘤乏氧介导的血管新生通路,采用了一个FDA批准的受体酪氨酸激酶抑制剂Sunitinib,来实现XPDT和抗血管新生协同治疗。
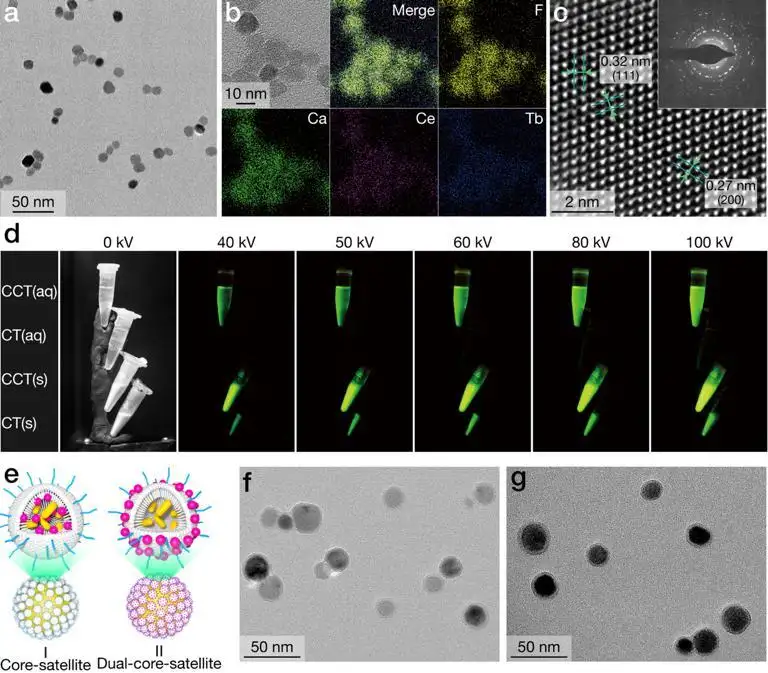
纳米闪烁体的表征及双-核卫星纳米平台的构建
体外研究表明该纳米平台在较低的给药剂量和较低的辐照剂量下即具有显著的抗血管新生效应和PDT效果。其PDT效果来源于X射线照射时产生的单线态氧;WB实验表明其抗血管新生效应和VEGFA, HIF-1a, P-STAT3等酶的下调相关。体内实验结果表明,在1 Gy的辐照剂量下,协同治疗可以导致肿瘤组织细胞大面积凋亡,同时肿瘤血管密度显著减小。表明X射线光动力治疗和抗血管新生治疗确实具有很好的互补作用,可以从不同方面对肿瘤进行攻击并防止其逃逸,这种组合作战的策略实现了对深部肿瘤高效的清除效率。

体内治疗效果评估
最后,毒理学评估表明,该纳米平台没有明显的短期或长期毒性。这是因为闪烁体中的Ca和F元素在人体是广泛存在的;光敏剂Rose Bengal是一个已在临床使用的眼科诊断试剂;血管新生抑制剂Sunitinib是FDA批准的药物。也就是说,该纳米平台具有极高的生物安全性,在深部肿瘤的治疗中具有广阔的应用前景。
博士研究生姜朝为论文第一作者,李万万研究员和崔大祥教授为论文的共同通讯作者。这项工作得到了电子信息与电气工程学院崔大祥教授和新加坡国立大学(National University of Singapore ) 陈小元教授的帮助。同时,研究工作得到了国家重点研发计划纳米专项、国家自然科学基金面上项目和上海市科委基金项目等的资助。
论文链接:
https://pubs.acs.org/doi/10.1021/acsnano.1c01063?ref=pdf
本文版权归原作者所有,文章内容不代表平台观点或立场。如有关于文章内容、版权或其他问题请与我方联系,我方将在核实情况后对相关内容做删除或保留处理!