
经过长时间的进化,沙堡蠕虫、甲壳类、贻贝、条鱼、条栉水母和牡蛎等海洋动物通过邻苯二酚化学、图案结构、原位纳米颗粒形成等已经掌握了水下粘附的秘密。许多海洋生物可以分泌含有纤维蛋白线、粘蛋白等的流动胶,这有助于它们在水下粘附于各种固体底物。该胶能在海水中原位固化,显著提高粘接强度。这种方便、智能的粘接具有注射性、强度、按需粘接等优点,同时又能避免不良粘接。然而,这种精致的设计对于合成的软物质来说仍然是罕见的。其根本原因在于:首先,现有的可注射水凝胶在水中大部分是不稳定的,难以实现对软组织的高水下粘附强度。在一些情况下,引入一些特殊手段(例如,热,紫外线辐射,溶剂交换,pH变化,强氧化剂)可能有助于实现注射水凝胶相对稳定的凝胶化。然而,它们可能引起额外的细胞毒性,因此大大限制了其适用范围。第二,原位水下可调胶粘剂/非胶粘剂界面仍然是一个挑战,近年来,人们通过温度变化、金属离子或低聚糖溶液、发泡剂、光热效应、磁场等手段来实现特定的黏附性或可调节的黏附界面。这些报道的方法可以创建非粘合界面和/或促进脱粘过程,但通常很难应对水下情况。一旦整个粘接过程在过量的水中进行(如海洋中),基本上就不适用了,因此后续调节水下粘接/非粘接界面实践中变得非常困难。此外,由于缺乏相关条件和设备,它们可能不适合一些极端情况,如战争或室外紧急情况。
基于以上研究,北京大学黄建永研究员组将一种氢键离解剂(HBD)引入物理交联水凝胶网络,以实现水凝胶可注射性,如示意图所示。假设HBD分子可能会逐渐扩散到周围的水环境中,通过恢复分离的物理交联而留下一个自增强的水凝胶。因此,所开发的可注射水凝胶能够在水下与多种固体基质(如玻璃或新鲜猪皮)形成有效的粘附。由于小酰胺分子的扩散,水凝胶及其水下附着具有自增强作用,抗拉强度达到1MPa,对猪皮的水下附着强度达到152.9kPa。

Scheme 1. a)注射用G0.6-T0.6-U0.12水凝胶的组成。b)可注射G0.6-T0.6-U0.12的在新鲜猪皮有效水下黏附机理。c)扩散引发的自强化效应以及 “粘接剂/非粘接剂”界面的形成。
结果发现,由于小酰胺分子的扩散,水凝胶及其水下附着具有自增强作用,抗拉强度达到1MPa,对猪皮的水下附着强度达到152.9 kPa。更重要的是,这是首次在没有任何附加处理或紫外线辐射等外界刺激的情况下,“非粘接”界面通过扩散出现,而没有干扰“粘接”界面。结合水下3D打印性、细胞相容性、生物降解性和抗菌活性(图1),这一水凝胶的制备为设计高性能和智能水下粘合剂提供了新策略,在各种应用中特别是在生物医学、电子、仿生微器件等方面具有重要意义。
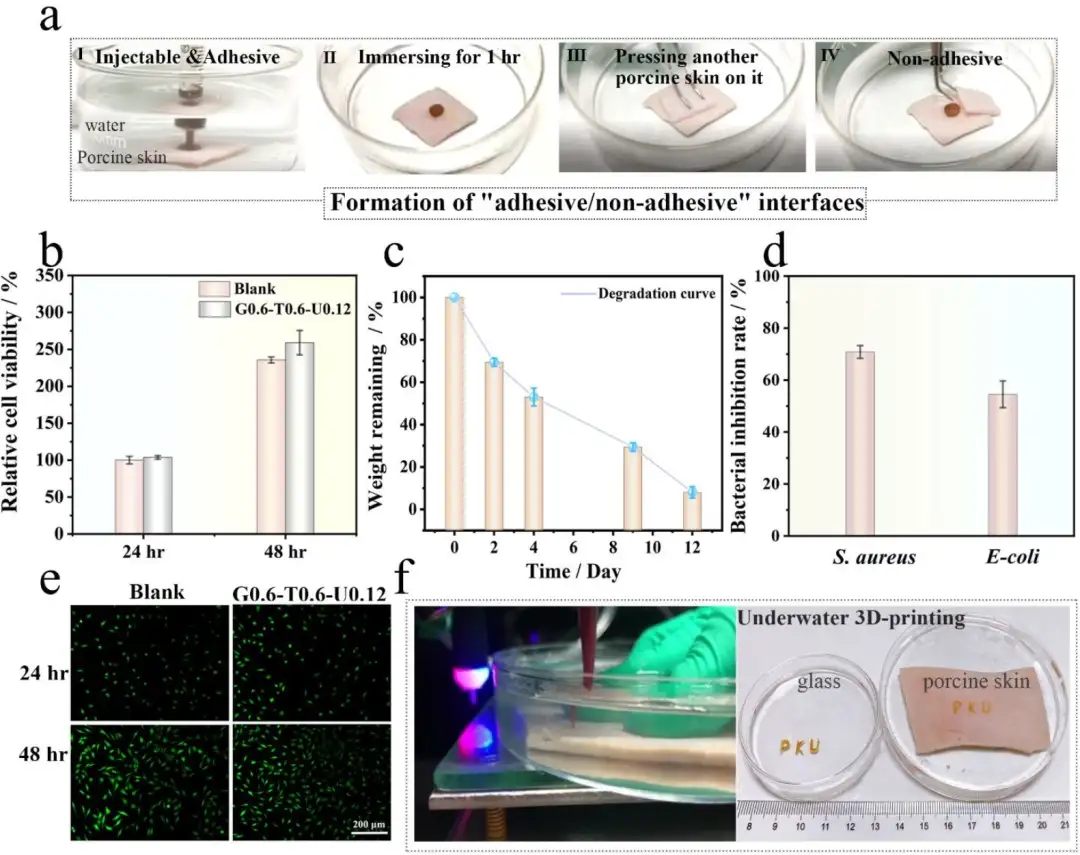
Figure 1 a)在水中形成G0.6-T0.6-U0.12的“不粘”面。b-d)G0.6-T0.6- U0.12的细胞相容性、降解率,抑制细菌活性的统计分析。e) G0.6-T0.6-U0.12水凝胶提取物中的纤维母细胞共聚焦激光扫描显微镜(CLSM)图像。f) G0.6-T0.6- U0.12在一片猪皮上的水下3D打印操作演示左侧),水下3D打印“北大”字样。
结论:受海洋生物启发,作者开发了一种扩散触发的智能黏附水凝胶,可以在不同的水环境中与各种材料形成高效、自强化、持久的界面粘附。特别地,它不仅能够稳定牢固地粘附水中的柔软生物组织(如新鲜猪皮,其最大粘附强度高达152.9 kPa),而且通过尿素的扩散,创造出智能的粘附/非粘附界面。这些独特的优势(表S2),结合其优良的生物相容性、抗菌活性,生物降解性以及高注射能力和3D打印特性,表明合成的水凝胶能够适用于各种与界面粘附等生物医学相关的区域和灵活的电子产品。更重要的是,目前的工作揭示了环境水引发的尿素扩散在调节水下智能附着中的关键作用。这一发现不仅为高性能水下胶粘剂的设计和合成提供了一种新的方法,而且为开发功能分子扩散调控的智能水凝胶铺平了道路。
全文链接:
https://pubs.rsc.org/en/content/articlelanding/2021/mh/d1mh00533b#!pAbstract
原文刊载于【高分子科学前沿】公众号
本文版权归原作者所有,文章内容不代表平台观点或立场。如有关于文章内容、版权或其他问题请与我方联系,我方将在核实情况后对相关内容做删除或保留处理!