胃癌是我国最常见的消化系统恶性肿瘤之一,严重影响人民健康。目前,由于胃癌的肿瘤异质性和化疗药物的耐药等问题,进展期胃癌综合治疗效果欠佳,因而开发新型胃癌治疗药物意义重大。近两年,兰州大学第二医院焦作义团队从胃癌治疗的临床问题出发,通过胃癌治疗靶点筛选、临床大样本验证,分子机制深入挖掘、靶向天然药物筛选和胃癌人源化模型建立,在胃癌发病和靶向药物耐药机制以及天然靶向药物开发等领域取得重要进展。
近日,团队研究发现,HER2下游存在一条新的信号通路HER2/SHC1/SHCBP1/PLK1,该信号通路的异常激活与赫赛汀耐药密切相关。并据此筛选发现了新型的SHCBP1-PLK1复合体的抑制剂茶黄素-3, 3’-双没食子酸(TFBG),TFBG可显著增敏赫赛汀治疗胃癌的疗效。该项研究成果揭示了HER2调控肿瘤生长的新机制,为研发赫赛汀临床增敏剂提供了新思路。上述成果以“Hyperactivation of HER2-SHCBP1-PLK1 axis promotes tumor cell mitosis and impairs trastuzumab sensitivity to gastric cancer”为题在期刊Nature Communications上发表,焦作义和孙辉教授为共同通讯作者,萃英生物医学研究中心博士后石文贵、博士研究生张耕源为共同第一作者。

原文连接:https://www.nature.com/articles/s41467-021-23053-8
此外,焦作义团队还针对Wnt/β-catenin信号通路异常的胃癌患者,在新治疗靶点和靶向天然药物开发方面取得了重要进展,该成果阐明了β-catenin破坏复合物关键蛋白RACK1在胃癌中缺失的上游泛素化调控机制,发现泛素结合酶UBE2T作为治疗胃癌的有效靶点,在调控Wnt/β-catenin信号通路中发挥着重要作用。更值得关注的是该团队基于有效靶点UBE2T进一步研发了有效治疗胃癌的天然药物柴胡皂苷,为Wnt/β-catenin信号通路异常激活的胃癌患者靶向药物开辟了新前景。相关研究成果以“A novel UBE2T inhibitor suppresses Wnt/β-catenin signaling hyperactivation and gastric cancer progression by blocking RACK1 ubiquitination”为题发表于Oncogene,焦作义和孙辉教授为共同通讯作者,博士研究生俞泽元为第一作者。

原文连接:https://www.nature.com/articles/s41388-020-01572-w
上述成果研究得到国家自然基金项目及甘肃省重点研发计划等项目支持。这两项研究从目前临床上胃癌治疗存在的问题出发,在胃癌治疗的新靶点及天然药物的研发方面取得了重要进展。该成果在线发表后,引起了国内外肿瘤学界和生物医药行业的高度关注和广泛兴趣,为胃癌临床靶向治疗提供了新思路,也对中药单体天然药物研发产生了有力推动作用。
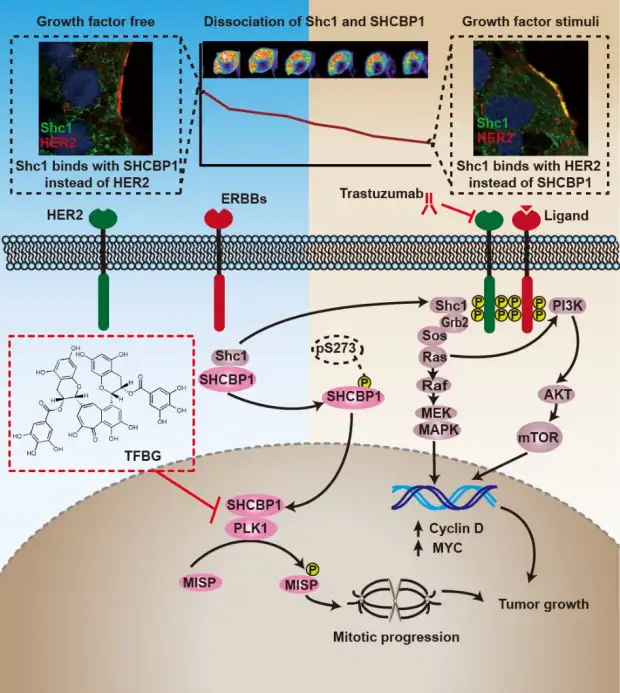
图1.该研究发现胃癌治疗靶点HER2下游存在一条新的信号通路HER2/SHC1/SHCBP1/PLK1,该信号通路的异常激活与胃癌靶向药赫赛汀的耐药密切相关。茶黄素-3, 3’-双没食子酸(TFBG)是SHCBP1-PLK1复合体抑制剂,其与胃癌靶向药物赫赛汀联用,表现出优异的抗HER2阳性胃癌的疗效(Shietal.NatureCommunications)。

图2. 这项研究阐明了β-catenin破坏复合体关键蛋白RACK1在胃癌中被上游的泛素化结合酶UBE2T降解的分子机制,并靶向UBE2T开发了低细胞毒性的小分子抑制剂,可在体内外抑制胃癌的进展(Yuetal.Oncogene)。
本文版权归原作者所有,文章内容不代表平台观点或立场。如有关于文章内容、版权或其他问题请与我方联系,我方将在核实情况后对相关内容做删除或保留处理!