作者:Huibin
来源:遇见生物合成

遇见/摘要
人工生物合成途径可以通过多酶级联或一锅法反应等合成目标化合物。本文作者报道干扰素基因刺激蛋白(STING)激动剂MK-1454酶法级联合成路线,首先底物2′F-thioAMP和3′F-thioGMP在三种激酶的作用下一锅两反应分别生成两种硫代三磷酸核苷酸,随后在工程化改造的环鸟苷酸-腺苷酸合成酶(cGAS)生物催化作用下偶联环化生成MK-1454。值得注意的是,其中一种硫代三磷酸核苷酸2′F-(Sp)-thioATP发展成为激酶途径中的非天然辅因子回收系统,本文研究丰富对人工生物合成途径的相关认识。
遇见/内容
环状二核苷酸(CDN)作为STING激动剂,临床上常用作肿瘤免疫小分子药物,其与内源性非典型环二核苷酸STING激动剂2'3'-cGAMP结构相似。之前研究中发现多种非天然核苷酸三磷酸(NTPs)与野生型人源cGAS反应可以产生新的CDN,此外可以通过改变与碱基和糖等连接的官能团并结合基于P(III)的化学合成方法等多向性合成CDN(图1a)。磷的立体化学因素对其生物学活性产生影响(3a-3d,图1b)。基于以上研究基础化合物MK-1454 (1)目前已进入临床阶段,X射线晶体复合物结构表明MK-1454的磷酰氧基与Arg238的相互作用对活性至关重要,进一步印证MK-1454的Rp/Rp立体化学因素的重要性(图1c)。
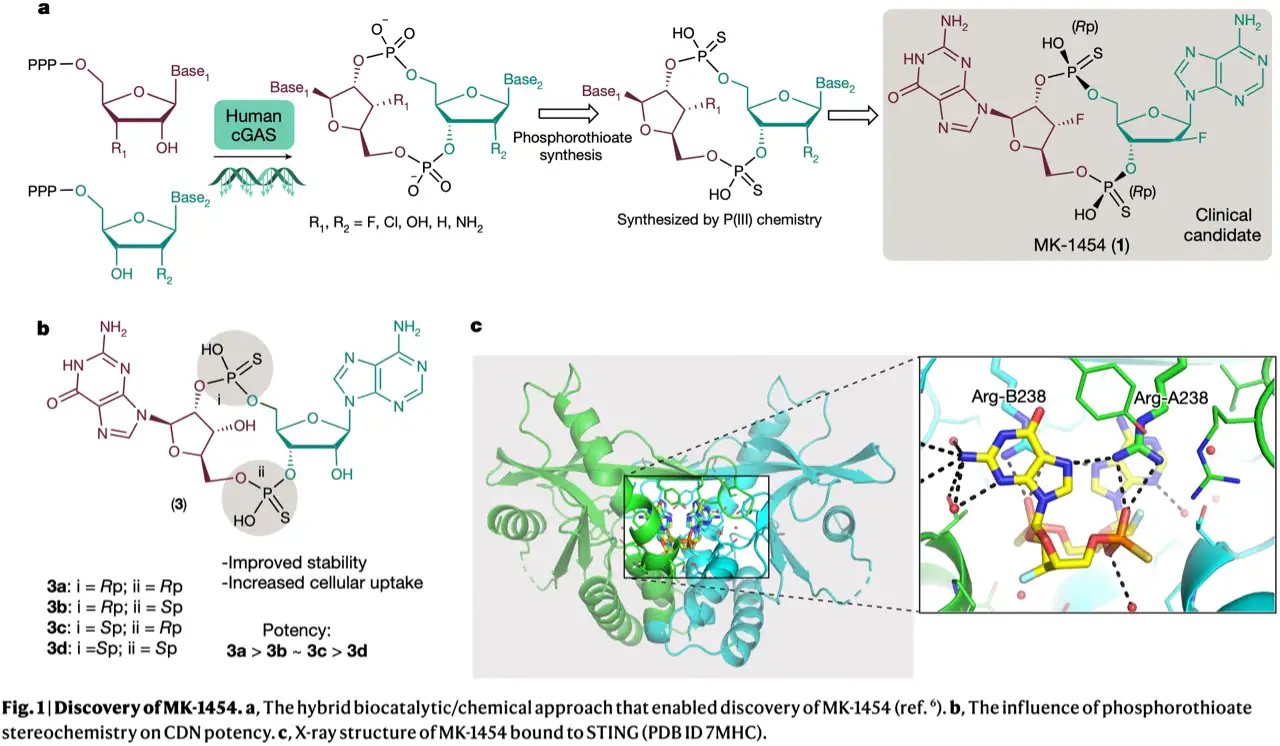
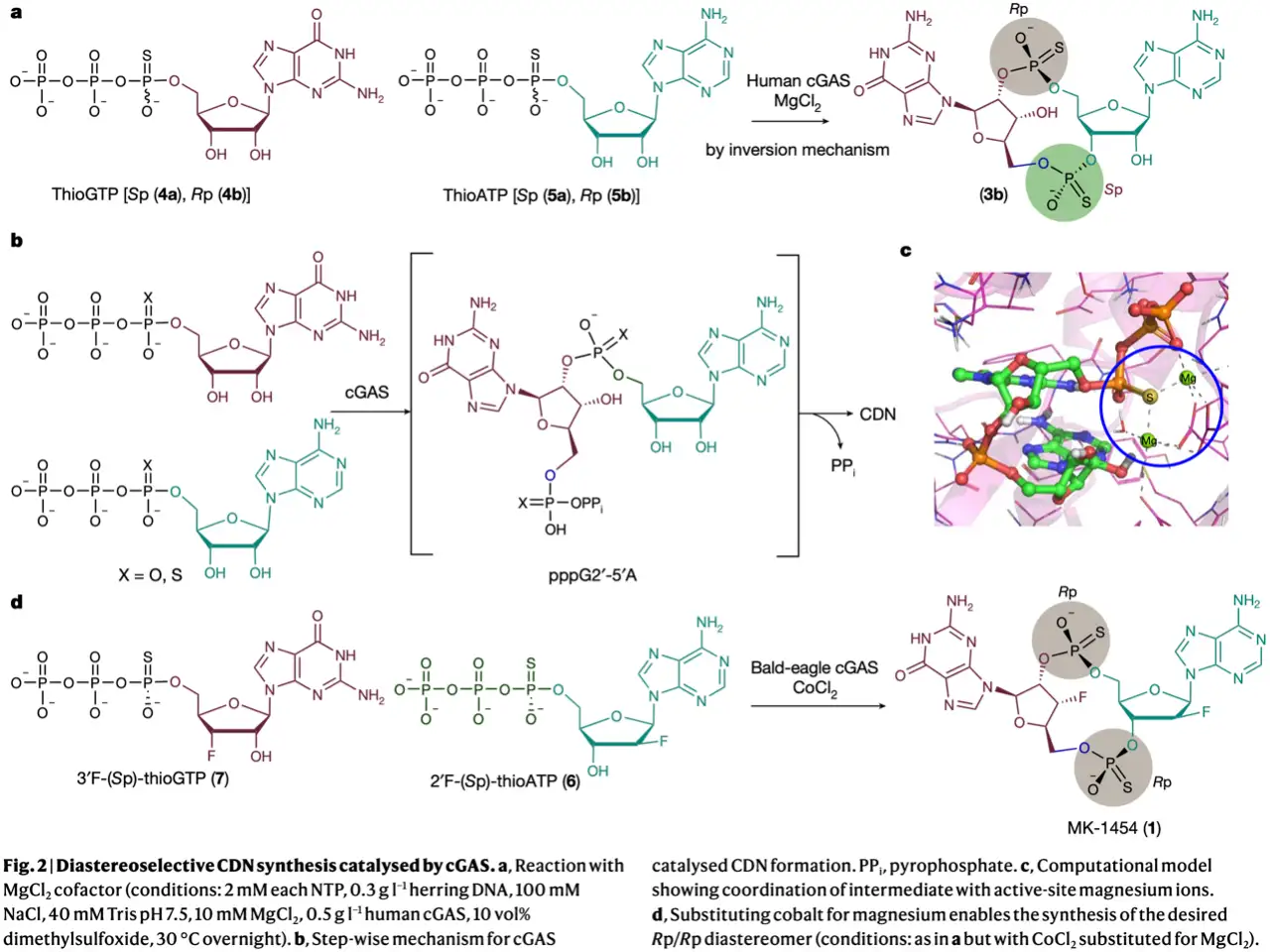
在之前MK-1454的合成工艺中,P(III)化学方法需要九个步骤并涉及不稳定的中间体和多个保护基团等操作。本文作者设计通过工程化改造cGAS用于立体选择性控制。作者首先利用thioGTP(4)和thioATP(5)与人源环鸟苷酸-腺苷酸合成酶(cyclic guanosine-adenosine synthase, cGAS)反应,其中只有(Rp)-thioGTP(4b)和(Sp)-thioATP(5a)的组合产生环化产物3b(图2a)。环化反应过程如图2b所示,GTP的2'-OH进攻ATP的α磷形成线性二核苷酸三磷酸中间体pppG2'-5'A,之后进行环化反应。鉴于只有含有(Rp)-thioGTP的立体异构体的反应产生环状产物,作者通过分子对接发现cGAS立体化学偏好硫代磷酸酯氧原子优先与镁离子配位,将镁离子置换为钴离子可以生成包括Rp/Rp-二硫代cGAMP在内的三种非对映异构体(图2c)。接下来作者利探索MK-1454合成所需的底物2'F-(Sp)-thioATP(6)和3'F-(Sp)-thioGTP(7)的反应性,通过筛选cGAS同源文库将来源于白头海雕的cGAS作为定向进化改造的起点,此外结合金属辅因子筛选发现Zn2+/Co2+条件下产量进一步提升(图2d)。
接下来作者研究核苷酸1-硫代三磷酸的生物催化合成方法,作者推测硫代二磷酸可以由腺苷酸激酶(AK)或鸟苷酸激酶(GK)合成,之后使用高能磷酸供体通过第三种激酶进行立体选择性三磷酸化(图3a)。经过筛选作者鉴定出Sp选择性磷酸化的AK和GK,之后与乙酸激酶(AcK)反应分别生成6和7。
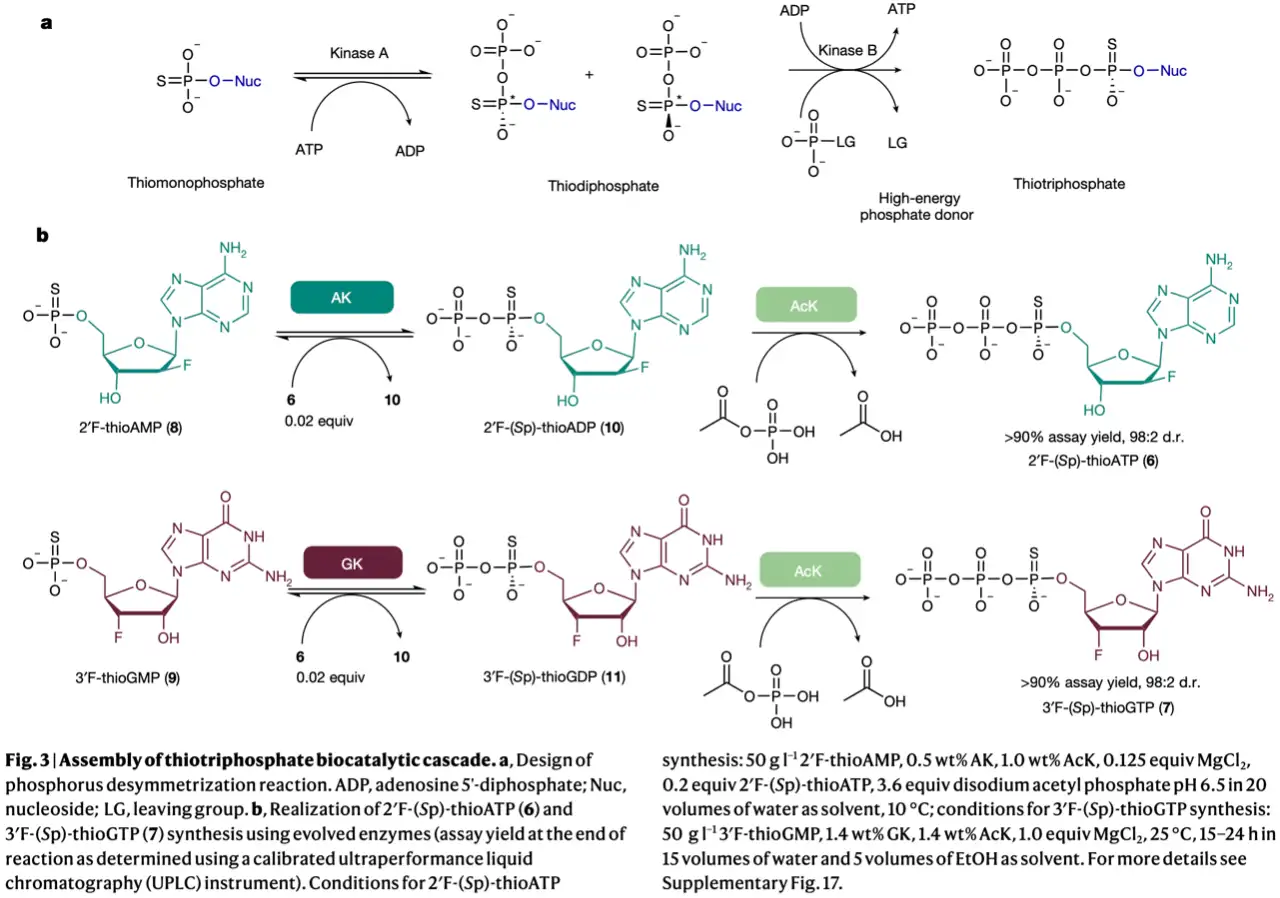
但是AK和GK的天然辅因子ATP造成交叉反应性问题,将ATP引入环化步骤与3'F-(Sp)-thioGTP(7)底物竞争性环化生成难以分离的新CDN副产物(补充图14)。

为解决上述问题,作者发现2'F-(Sp)-thioATP(6)是AK/AcK激酶级联产物之一,可能作为AK和GK的磷酰基供体。接下来作者对AK、GK和AcK进行定向进化改造改变其底物和辅因子偏好(图3b)。
经过定向进化和辅因子偏好改造,可以使用相同的辅因子6用于一锅两反应合成硫代三磷酸盐,鉴于反应的自催化性质,使用较少当量的6可用于引发级联反应。此外作者优化镁离子、乙酰磷酸浓度和酶负载量等优化反应。下一步作者将硫代三磷酸酯合成与cGAS环化反应耦合建立从核苷酸单硫代磷酸酯生成MK-1454的级联反应,调节硫代三磷酸盐体系的pH值以中和残留的乙酸后,只需添加纯化的cGAS、有机助溶剂和Zn2+/Co2+辅因子体系以62%的收率合成MK-1454(图4)。

本文作者通过定向进化改造酶的选择性(立体、底物、辅因子等),利用四种不同的酶形成六个键生成环状二核苷酸MK-1454的单一非对映异构体,体现出人工生物合成途径在药物制造领域广阔的应用前景。