癌症免疫疗法作为一种新兴的治疗策略,对治疗过程进行远程控制是最大化治疗效力和避免副作用的理想策略。中科院化学所的王树等人报道了一种用于在近红外光辐照下原位激活免疫疗法的共轭聚合物纳米颗粒(CPNs)介导的光遗传系统。这一系统由具有光热性能的CPNs和由热休克启动子(HSP70)驱动的干扰素-γ(IFN-γ)质粒组成,其中CPNs作为纳米换能器能够触发IFN-γ细胞因子的基因转录。凭借此策略,由肿瘤细胞分泌的IFN-γ足以引发周边肿瘤相关巨噬细胞的活化,从而最终实现免疫治疗杀死肿瘤细胞。因此,研究认为这一系统为远程控制免疫治疗提供了新型策略。相关工作以“Near-Infrared-Light Remote-Controlled Activation of Cancer Immunotherapy Using Photothermal Conjugated Polymer Nanoparticles”为题发表在Advanced Materials。

【文章要点】
一、系统设计
研究利用吡咯并吡咯二酮(DPP)和噻吩衍生物通过Stille偶联反应构建了供体-受体(D-A)型共轭聚合物(图1),该聚合物与两亲性脂质体DSPE-PEG2000基于纳米沉淀的方法制备CPNs。由于DPP单元具有强大的吸电子能力,这些CPNs展现出了近红外宽带(600-900纳米)吸收能力。同时,近红外光辐照下CPNs几乎不展现荧光信号,这表明激发态失活的主要路径是非辐射性衰减。不仅如此,在近红外光辐照下,CPNs还展现出了优异的光热性能,其光热转换效率达到了26.9%。
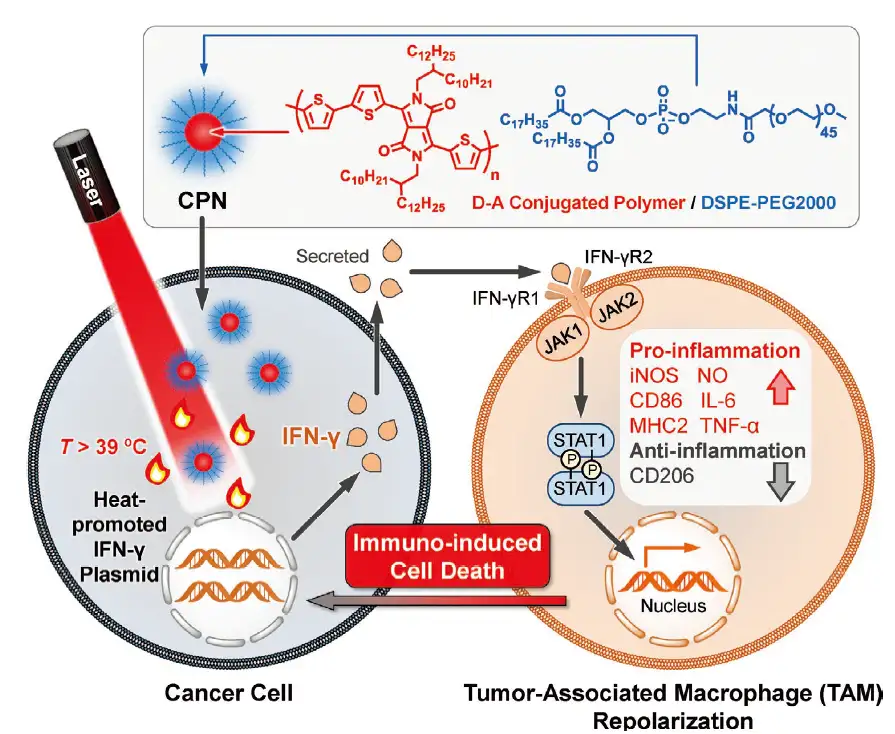
图1光热CPNs对免疫治疗实现远程控制
二、CPNs诱导热敏性基因表达
如图2所示,研究构建了能够表达促炎性细胞因子的可热诱导质粒,这一质粒由被HSP70启动子驱动的IFN-γ基因构成。在近红外光的辐照下,CPNs介导的光遗传平台能够触发HSP70下游基因表达,从而可激活并显著提高IFN-γ细胞因子在细胞内的表达水平。这些结果说明,CPNs介导的光遗传平台能够远程精确控制IFN-γ细胞因子的分泌和表达,而IFN-γ细胞因子又能够特异性地复极化肿瘤相关性巨噬细胞,从而进一步控制肿瘤细胞周边的免疫反应。
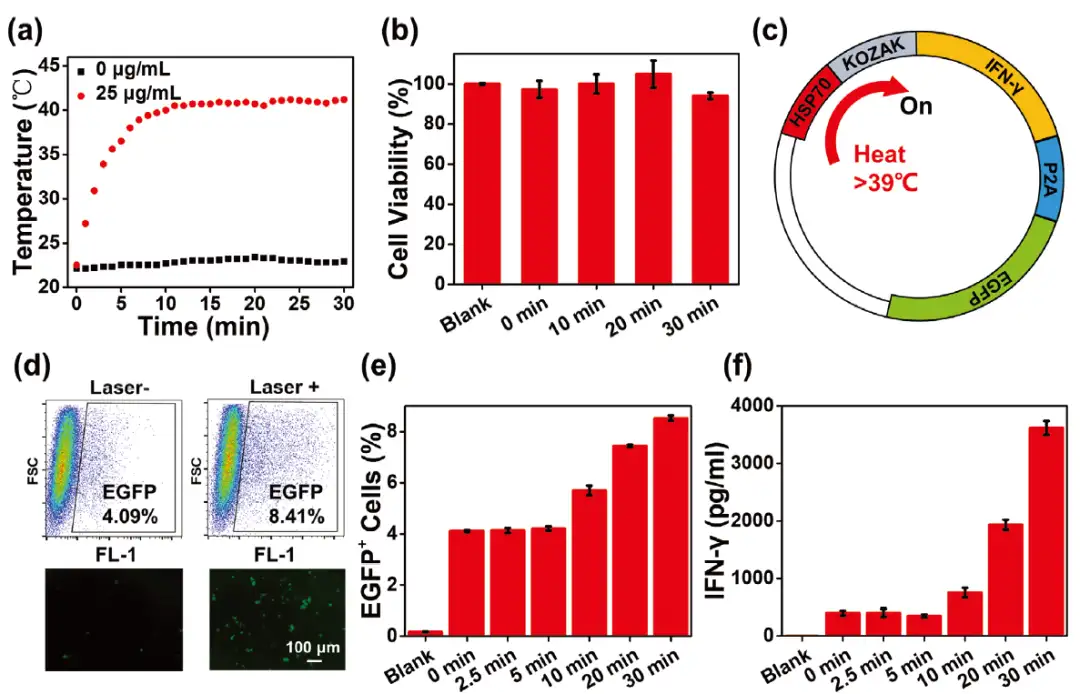
图2 CPNs诱导热敏性基因及促炎性细胞因子的表达
三、CPNs介导光遗传平台发挥抗癌效果
随着CPNs光遗传平台复极化肿瘤细胞周边的肿瘤相关巨噬细胞转变成促炎性的M1型,下游的免疫反应以及巨噬细胞的吞噬作用可被同时激活提升。进一步的细胞实验也证明,复极化的肿瘤相关性巨噬细胞被光遗传系统激活后可通过细胞-细胞通讯可发挥最佳的抗癌效果(图3)。
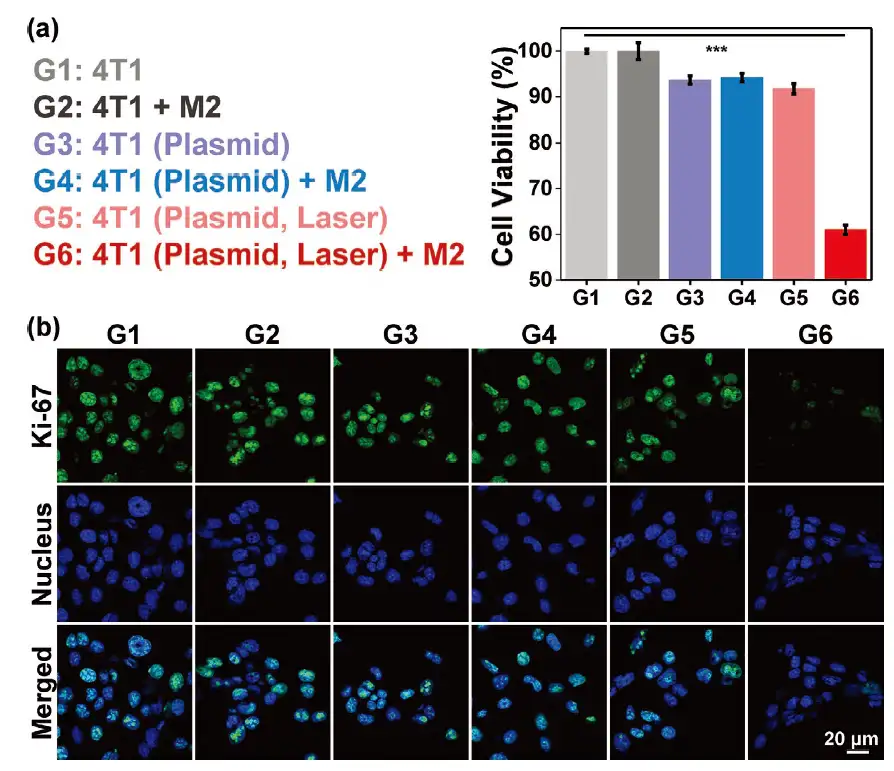
图3CPNs在细胞层面的抗癌表征
文献链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202102570
原文刊载于【高分子科学前沿】公众号
本文版权归原作者所有,文章内容不代表平台观点或立场。如有关于文章内容、版权或其他问题请与我方联系,我方将在核实情况后对相关内容做删除或保留处理!