来源:iNature(ID:Plant_ihuman)
腺苷到肌苷 (A-to-I) RNA 编辑和催化酶腺苷脱氨酶对于造血发育和分化都是必不可少的。然而,造血过程中的 RNA 编辑组及其潜在机制尚不清楚。
2021年8月13日,中国医学科学院/北京协和医学院程涛,余佳,马艳妮及程辉共同通讯在Blood(IF=22.11)在线发表题为“Comprehensive RNA editome reveals that edited Azin1 partners with DDX1 to enable hematopoietic stem cell differentiation”的研究论文,对不同阶段的 12 个小鼠成体造血细胞群进行了分类,并通过 RNA 测序确定了 30,796 个编辑位点。虽然 RNA 编辑组的动态景观由阶段/组特定和稳定的编辑模式组成,但在谱系承诺期间也发生了重大变化。
值得注意的是,该研究发现抗酶抑制剂 1 (Azin1) 在造血干细胞和祖细胞 (HSPC) 中被高度编辑。Azin1 编辑导致:(i) 氨基酸变化以诱导 Azin1 蛋白 (AZI) 易位至细胞核,(ii) 增强 AZI 对 DEAD box 多肽 1 (DDX1) 的结合亲和力以改变后者的染色质分布,以及( iii) 最终促进 HSPC 分化的多种造血调节因子的表达改变。总之,该研究结果描绘了 Azin1 RNA 编辑在造血细胞中的重要作用,该研究的数据集构成了在更广泛的基础上进一步研究 RNA 编辑的宝贵资源。
另外,2021年7月2日,中国医学科学院/北京协和医学院张英驰,程涛及博雅辑因集团袁鹏飞共同通讯在Signal Transduction and Targeted Therapy(IF=18.19)在线发表题为“Highly efficient gene editing and single cell analysis of hematopoietic stem/progenitor cells from X-linked sideroblastic anemia patients”的研究论文,该研究首次证明了使用基于 CRISPR/Cas9 技术策略来纠正疾病突变并挽救 ALAS2 表达和血红素生物合成。这项研究不仅提供了 ALAS2 突变作为人类 XLSA 发病机制中的致病因素的直接证据,而且还首次以单细胞分辨率提供了来自 XLSA 患者的 CD34+ HSPC 的综合转录谱。因此,该研究结果提供了对 XLSA 发病机制的重要见解(点击阅读)。
2021年3月24日,中国医学科学院/北京协和医学院朱平,施均及程涛团队合作在Blood在线发表了题为“Single-cell transcriptomics dissects hematopoietic cell destruction and T cell engagement in aplastic anemia”的研究论文,该研究利用单细胞转录组测序技术,克服骨髓残留HSPC数量不足的限制,对再障患者的骨髓损伤机制以及T细胞免疫攻击机制进行了深入解析。这是继血细胞图谱(Atlas of Blood Cells, ABC)联盟在正常生理血细胞转录图谱绘制完成后,首次在再生障碍性贫血中绘制血液病理图谱,揭示了再生障碍性贫血发病,特别是恶性转化的新机制,将进一步推动以血液生态为出发点的生理及病理研究。
2021年2月22日,中国医学科学院/北京协和医学院马小彤及程涛团队合作在Blood在线发表题为“TWIST1 preserves hematopoietic stem cell function via CACNA1B/Ca2+/mitochondria axis”的研究论文,该研究首次证实TWIST1是成体HSC的重要调控因子,通过调节CACNA1B-钙离子-线粒体通路,维持稳态和应激状态下HSC功能。总之,该研究揭示了钙离子、线粒体在HSC稳态维持和应激保护中的重要作用,为阐明HSC命运调控机制提供了新线索。
2021年2月3日,北京大学,中国医学科学院/北京协和医学院,海军军医大学,首都医科大学等40多家单位联手合作,张泽民,周鹏辉,蒋庆华,黄志伟,贝锦新,卞修武,刘新东,程涛,赵平森,王福生,苏冰,王红阳,张政,瞿昆,王晓群,陈捷凯,金荣华等共同通讯在Cell在线发表题为“COVID-19 immune features revealed by a large-scale single cell transcriptome atlas”的研究论文,该研究对来自196名COVID-19患者和对照的284个样品应用了单细胞RNA测序,并创建了一个拥有146万个细胞的全面免疫环境。大型数据集能够确定不同的外周免疫亚型变化与COVID-19的年龄,性别,严重性和疾病阶段等不同的临床特征有关。SARS-CoV-2 RNAs存在于多种上皮和免疫细胞类型中,并伴随病毒阳性细胞内的转录组显著变化。S100A8 / A9的系统性上调主要由外周血中的巨核细胞和单核细胞引起,可能导致重症患者中频繁观察到的细胞因子风暴。该研究数据为了解COVID-19的发病机理和制定有效的治疗策略提供了丰富的资源(点击阅读)。

造血干细胞和祖细胞 (HSPC) 稳态需要协调复杂的途径,以平衡 HSPC 自我更新与分化为成熟血细胞。与表观遗传学一样,参与细胞周期调控、细胞凋亡和转录调控的基因在这一过程中发挥着重要作用。例如,转录后修饰(如 RNA 编辑)在 RNA 水平上改变序列信息,也可以调节 HSPC 功能。
腺苷转肌苷 (A-to-I) RNA 编辑是哺乳动物中最普遍的 RNA 编辑形式。肌苷在测序数据中被解释为鸟苷,A-to-I 编辑被识别为 A-to-G 错配。腺苷转肌苷过程由腺苷脱氨酶(ADAR)催化。
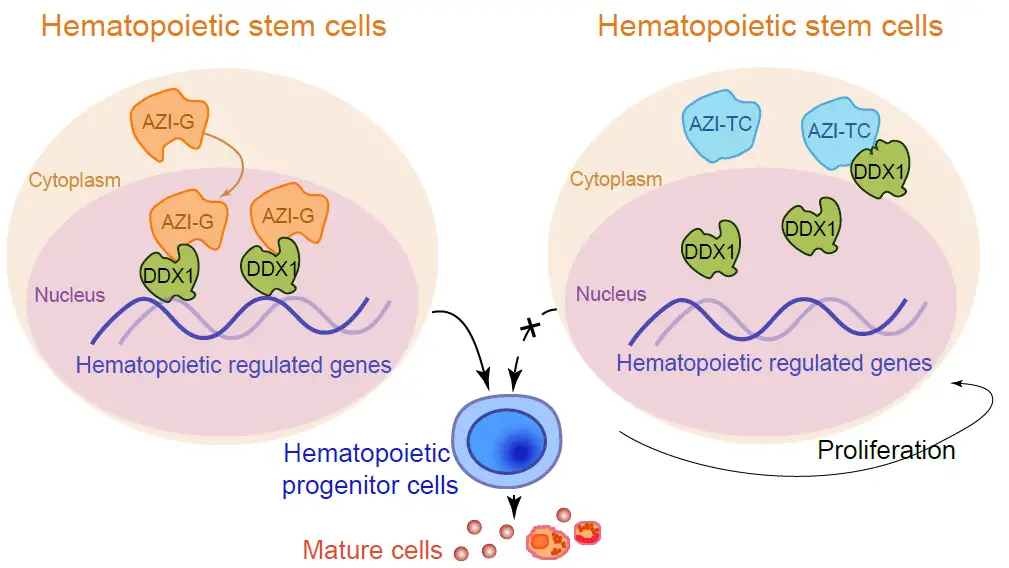
文章模式图(图源自Blood)
ADAR蛋白家族中,ADAR1在各种组织中广泛表达,参与造血功能。小鼠中的 Adar1 敲除会导致胚胎致死,这可能是由于胎儿肝脏中的造血功能缺陷所致。此外,在成人造血过程中,由于分化为祖细胞和成熟血细胞的缺陷,Adar1 等位基因的条件性缺失会损害造血干细胞 (HSC) 的补充能力。然而,潜在的机制是未知的。
该研究对 12 个小鼠造血种群进行了全面的 DNA 和 RNA 测序分析,以识别 A-to-I 编辑位点并绘制造血过程中的 RNA 编辑图谱。该研究确定了几个特定于阶段的编辑站点,包括 Azin1 中的一个重新编码编辑站点,它在 HSPC 中被高度编辑。编辑过的Azin1 通过增强其对 DDX1 的蛋白质结合亲和力并影响各种造血调节因子来维持 HSPC 分化。该研究发现为未来造血中 RNA 编辑的研究提供了宝贵的资源。
参考消息:
https://ashpublications.org/blood/article-abstract/doi/10.1182/blood.2021011314/476580/Comprehensive-RNA-editome-reveals-that-edited?redirectedFrom=fulltext

本文版权归原作者所有,文章内容不代表平台观点或立场。如有关于文章内容、版权或其他问题请与我方联系,我方将在核实情况后对相关内容做删除或保留处理!